多学科结合在肿瘤护理中的重要性日益凸显。放射治疗作为治疗癌症的一种重要方式之一,是肿瘤护理必不可少的一部分,然而,人们对放射肿瘤学领域仍知之甚少。
近日俄勒冈健康与科学大学的Ravi A Chandra和Charles R Thomas Jr,麻省总医院的Florence K Keane,以及荷兰癌症研究所的Francine E M Voncken,联合在顶级医学期刊《柳叶刀》上发表重磅综述。

论文首页
在这篇综述中,他们讨论了治疗技术和成像技术的进展,以及系统治疗和手术技术进展的相互作用,同时还回顾了放射肿瘤学的最新前沿进展,增强非放射肿瘤学家对放射肿瘤学的认知。
新的技术:不断发展的放射治疗
诊断成像、治疗计划和治疗实施方面的改进,使对病变组织的治疗更加精确的同时避开健康组织,这扩大了治疗窗口。由于组织密度的差异和计划设计能力的限制,传统放疗治疗区域大,放疗剂量不均匀。
CT成像的使用提高了精确度。此外,适形放疗与三维技术的发展,有助于评估放疗对肿瘤和器官的损伤风险,了解放疗剂量和毒性之间的关系。调强放疗和图像引导放疗的使用,显著降低了治疗相关的毒性,改善了长期预后。
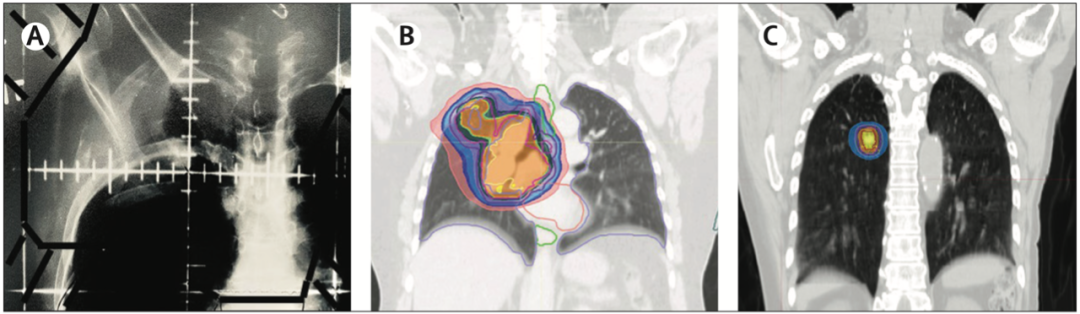
放疗从二维到立体定向放射治疗的演变
利用MRI或PET的直线加速器可以使组织定位更加精确,并可以在治疗过程中随肿瘤大小或位置的变化进行调整。化疗应用范围的增加,如镭-223在前列腺癌中的应用、治疗诊断学、伽马刀治疗、图像引导的近距离放射治疗等,也扩展了放射肿瘤学的临床应用范围。
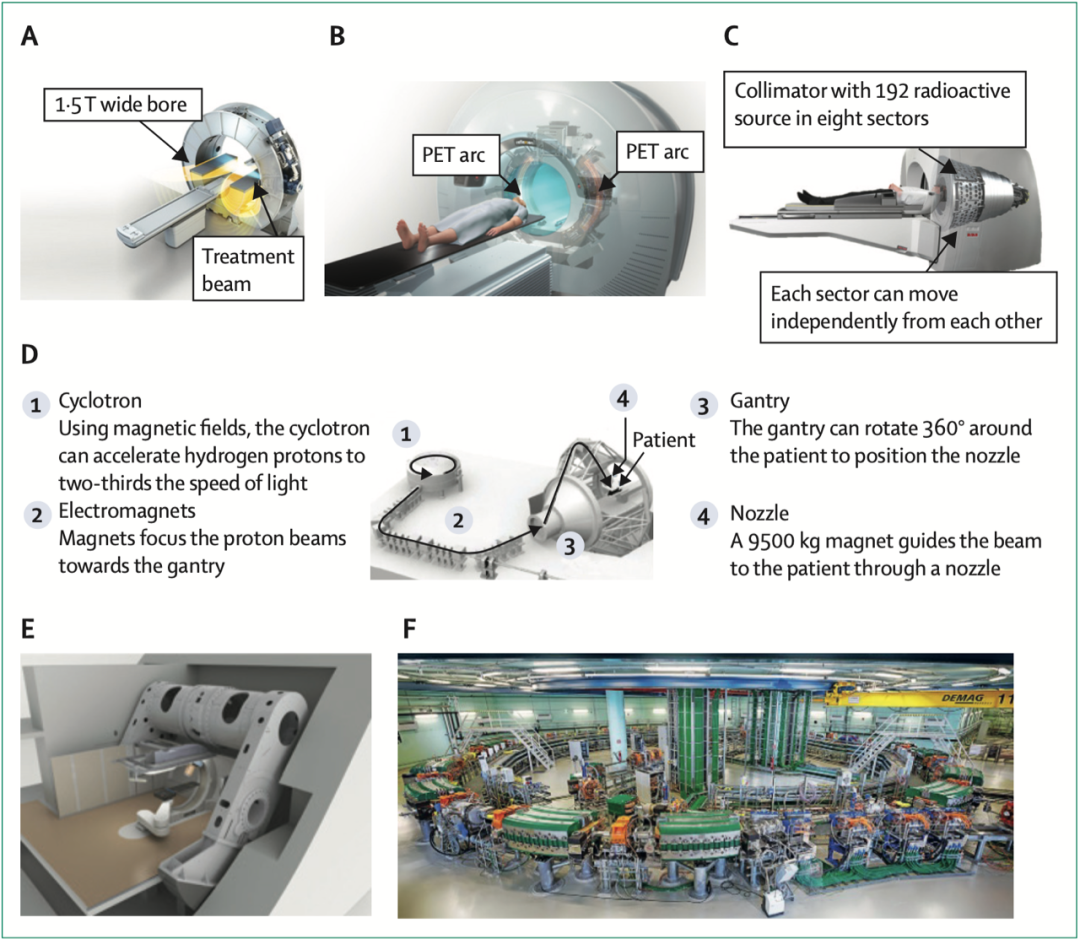
新型放射治疗仪
目前带电粒子治疗,如质子和碳离子治疗等的应用已大幅增加,此方法对目的细胞杀伤作用更强,对临近组织放射性毒副作用更小,可以大大减少健康组织接受放疗的风险,减少短期和长期的副作用。在治疗儿科患者或肿瘤接近颅底等重要部位的患者时,可以发挥重要作用。
带电粒子治疗的应用标准相关研究进展迅速,这些研究关注总生存期和无进展生存期,也关注生活质量和成本效益。利用质子治疗的剂量优势,需要准确预测质子束在组织中的范围,这一范围可能受到多种因素的影响,包括但不限于患者基础状态、成像、目标和周围器官的运动、生物学效应、以及照射剂量算法造成的不确定性。随机试验对于验证质子治疗效果至关重要,例如,在一项局部晚期非小细胞肺癌的随机试验中,与调强放疗相比,质子治疗没有显示出毒性的减低。
随着放疗技术进步,低分割放射治疗的使用增加,与常规分割放疗相比,放疗次数更少,每次照射剂量更高。低分割放射治疗传统上仅应用于姑息治疗,且单次疗程已被证明与多次疗程的放疗同样有效。
根治性放疗是在数周内以小剂量的每日剂量提供有效的肿瘤杀伤剂量,同时将毒性降至最低。放疗技术的改进缩短了放疗疗程,同时可维持或改善常规分割放疗的疗效。在接受全乳放疗的早期乳腺癌患者中,多个随机试验已经确定了低分割放疗的有效性和安全性,且更推荐这一方案。
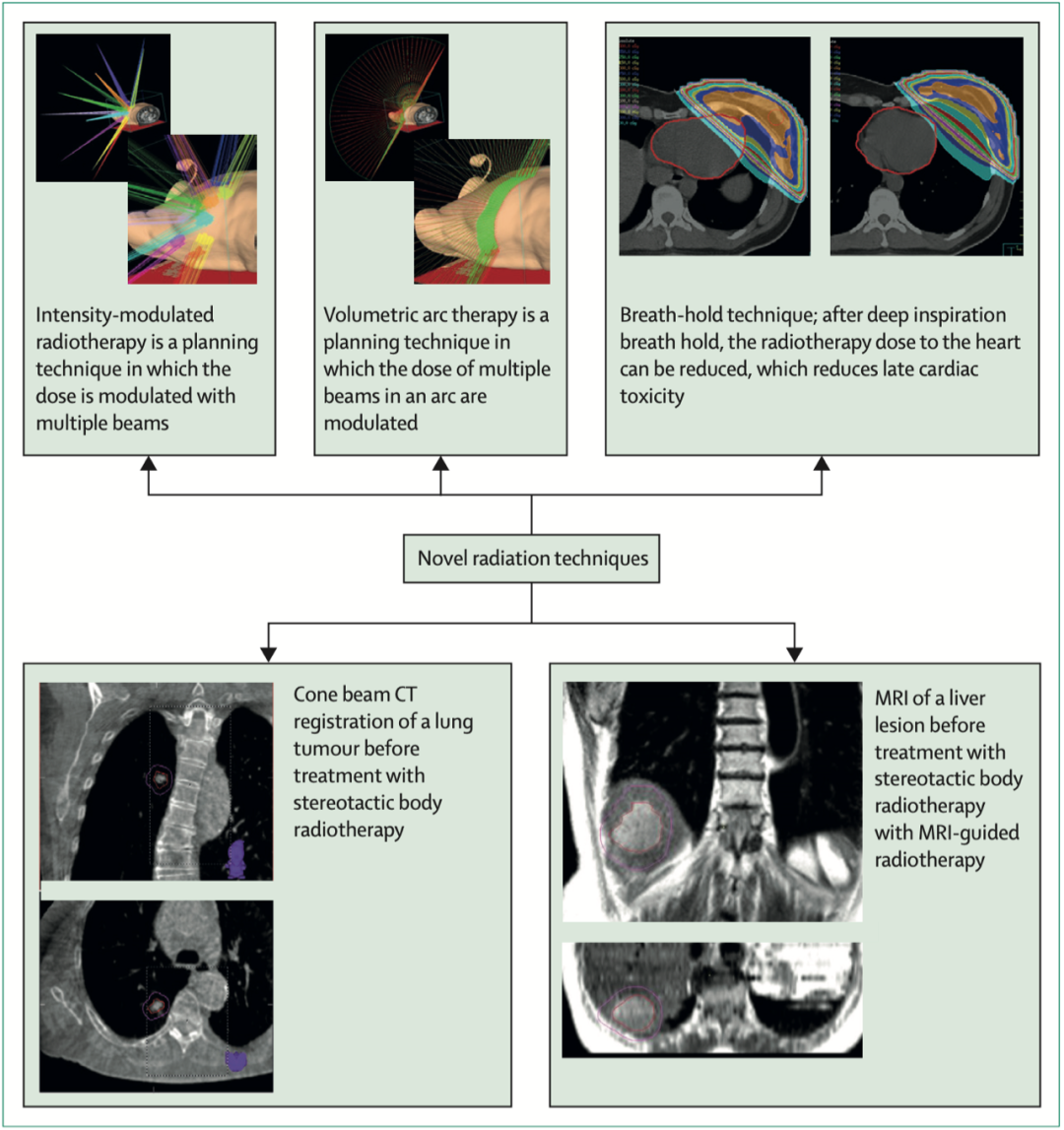
新型放疗技术举例
低分割、立体定向放射治疗或立体定向体部放射治疗(SBRT)最初是用于治疗颅内肿瘤,现在已经应用于多个身体部位,包括胸部、胃肠、泌尿生殖系统和骨骼等。SBRT也被称为立体定向消融放疗,其特点是将消融剂量的能量传递给肿瘤。这些新技术的作用随着系统治疗的发展而不断增加。
新的成像:改进的靶点定义,反应的定量,新的治疗方法
影像诊断学的进步有助于更精确地识别靶组织和健康组织。例如,MRI的改进使得对颅内疾病负担的评估比以前更加全面,导致脑转移治疗发生转变,从全脑放疗转向立体定向放疗或保留海马的全脑放疗。
放疗成像的其他进展包括四维(4D) CT的发展,CT可以在整个呼吸周期中获得,有助于更精确地测量肿瘤位置,对于肺、肝等随呼吸位移较大的部位的治疗尤为重要。
新的成像技术可以在治疗过程中进行成像。线性加速器可以配备先进的机载影像系统,如锥束CT,实时识别肿瘤的位置。MRI-线性加速器将MRI与线性加速器结合起来,在治疗前提供影像评估,在有器官运动的区域以及肿瘤和健康组织具有相似组织密度的区域(如胰腺或肝脏)起到重要作用。
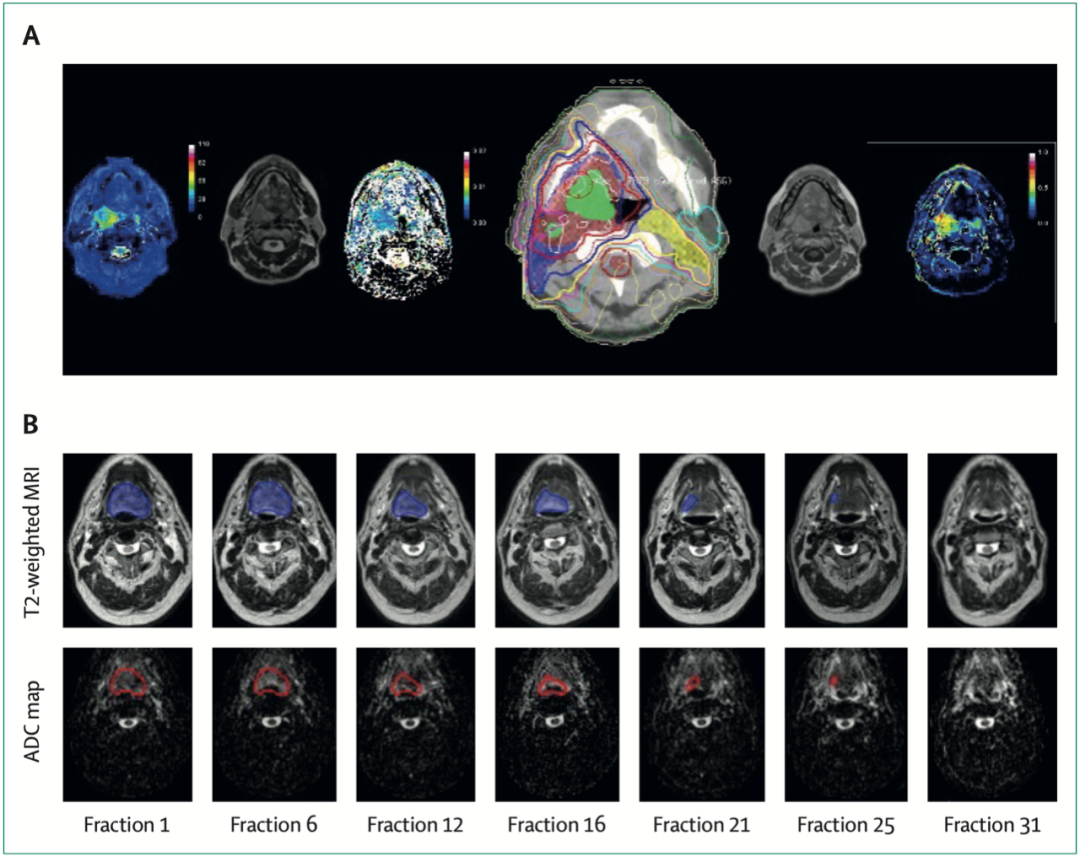
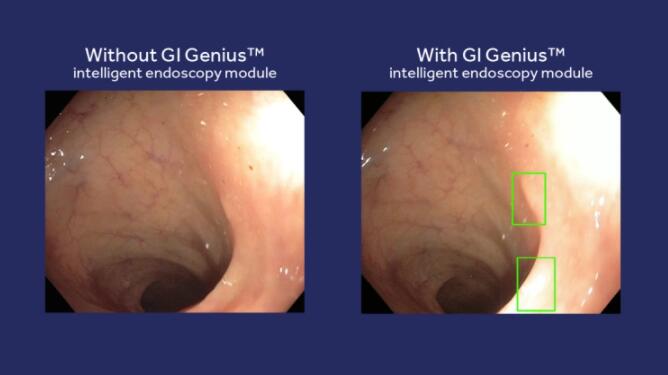
新成像技术在治疗计划反应分析中的应用举例
先进的成像技术还有助于评估治疗反应和额外的治疗需求。在胃食管交界癌中,使用PET-CT评估诱导化疗后的治疗反应,以确认系统治疗与放疗是否同时进行。功能成像在调强或减弱放疗中的作用研究目前正在进行中。功能MRI可以显示肿瘤的异质性,精确放疗靶区。其他进展包括基于成像和预测治疗反应确定合理放疗剂量等。
新的生物学:系统治疗下的角色变化
系统治疗的发展改变了放疗的作用,缩小了放疗靶区,降低了放疗的短期和长期潜在副作用。随着化疗与治疗的结合,PET或CT评估治疗反应等,与以前的治疗相比,目前的治疗剂量更小,与放射治疗相关的发病率降低。
免疫治疗和靶向治疗也极大地改善了患者的预后,研究表明,放射治疗可能刺激或增强对免疫检查点抑制剂的反应,因此放疗与免疫治疗联合治疗有一定前景。
在冷肿瘤中,如PD-L1阴性非小细胞肺癌、微卫星稳定的结肠直肠癌、胰腺癌等,放疗也能增加对检查点抑制剂反应。放疗具有免疫刺激和免疫抑制作用,机制包括肿瘤微环境的改变、细胞因子表达的改变、转录因子的上调、细胞死亡的诱导、和抗原交叉提呈的促进等。
放疗与免疫治疗的最佳组合是一个新兴领域,目前进行的临床前试验试图探索最佳剂量和分割以及潜在的作用机制。此外,靶向治疗的改进,特别是酪氨酸激酶抑制剂的发展等,也对治疗产生了积极影响。
放疗与免疫治疗和靶向治疗的相互作用值得注意,免疫治疗与放疗治疗时间接近时副作用可能增加,临床医生应意识到放疗与这些药物相互作用的潜在风险,了解这些药物的抑癌机制、药物半衰期,以及与放疗区域附近健康组织的相互作用机制,以此确定两种治疗的顺序。
同时需要考虑放疗和全身治疗之间重叠毒性的可能性。是否直接将系统治疗与放疗重叠,或在治疗期间进行系统治疗,应由负责治疗的放射肿瘤学家和内科肿瘤学家共同决定,充分考虑疾病的总体负担、放疗疗程的可能持续时间、以及两种治疗方法的重叠风险。
提高对肿瘤生物学的理解有助于降级治疗的发展,保持或提升治疗效果并最大限度地减少毒性。例如,在HPV相关的口咽鳞状细胞癌中进行放疗降级试验的结果表明,可适当选择患者进行放疗降级,HPV相关的口咽鳞状细胞癌比HPV阴性有更好的预后。但即使在预后良好的组中,也应进一步细化治疗亚组。
分子分型也有助于判断肿瘤对放疗的敏感性。识别对放疗敏感或不敏感的突变,有助于更好地预测哪些患者最容易发生局部肿瘤进展,从而促进个性化放疗的发展。
新的外科合作:不断发展的护理框架
随着多模式治疗的增加,许多癌症患者的预后已经改善,然而,强化治疗往往会对患者的生活质量产生影响。在不同肿瘤中,改善治疗结果和提升生活质量的需求不同。
乳腺癌、霍奇金淋巴瘤和头颈癌的治疗效果的提高促进了对降级治疗的探索,随着治疗效果的改变在手术和放疗取得平衡。对于胰腺癌、胃癌、食管癌等,强化治疗的目的是增加根治性手术的成功率,改善长期预后。

器官保留相关研究(部分)
肿瘤整形外科和现代放疗的发展提高了肿瘤患者治疗后的美观性,改善了患者的功能结局,如部分乳腺癌患者得以保留乳房,对于头颈部癌症,机器人手术的开展使以前因潜在并发症而认为无法切除的肿瘤得到治疗。
器官保留在肛门癌、头颈部癌、宫颈癌、膀胱癌中已经得到了很好的应用,在食管癌、直肠癌和直肠癌中应用的潜力也越来越大。新技术的发展和多学科合作大大提升了肿瘤患者的预后和生活质量。
特别的例子:立体定向放疗或SBRT
立体定向放疗和SBRT的发展和在多种疾病部位的使用,开启了放疗的新时代。SBRT的适应症范围较广,从早期疾病(如肺癌)到局部晚期疾病(如不可切除的胰腺癌)和转移癌。这些技术具有疗程短、剂量小,与之相关的副作用也小的优点。对于不适合肺叶切除的早期非小细胞肺癌患者,SBRT是标准的治疗方法。与常规分割放疗相比,SBRT可改善预后,降低毒性。
此外,立体定向放疗和SBRT在转移癌治疗中的潜在作用也是一个新兴领域。如T1-2N0肺癌肾上腺转移,结肠直肠癌肝转移,或肉瘤肺转移等,可进行积极局部巩固治疗并长期控制病情。然而,多部位转移的患者是否也能从积极的局部治疗中获益一直存在争议。
分子分型研究尝试定义寡转移(诊断时的低转移疾病)和寡进展(系统治疗后的低进展部位)疾病的表型。肿瘤遗传多样性和肿瘤进化的相关研究,支持了多个不同的生物学途径影响患者寡转移和寡进展疾病的假设。生物标志物(如循环肿瘤DNA)的进展也提高了对疾病负担评估。
多个2期临床试验为SBRT的使用提供了支持。在这些试验中,对寡转移性疾病的患者的原发部位和转移灶进行局部治疗,通常是SBRT,患者的无进展生存期显著延长。3期临床试验正在进行中。
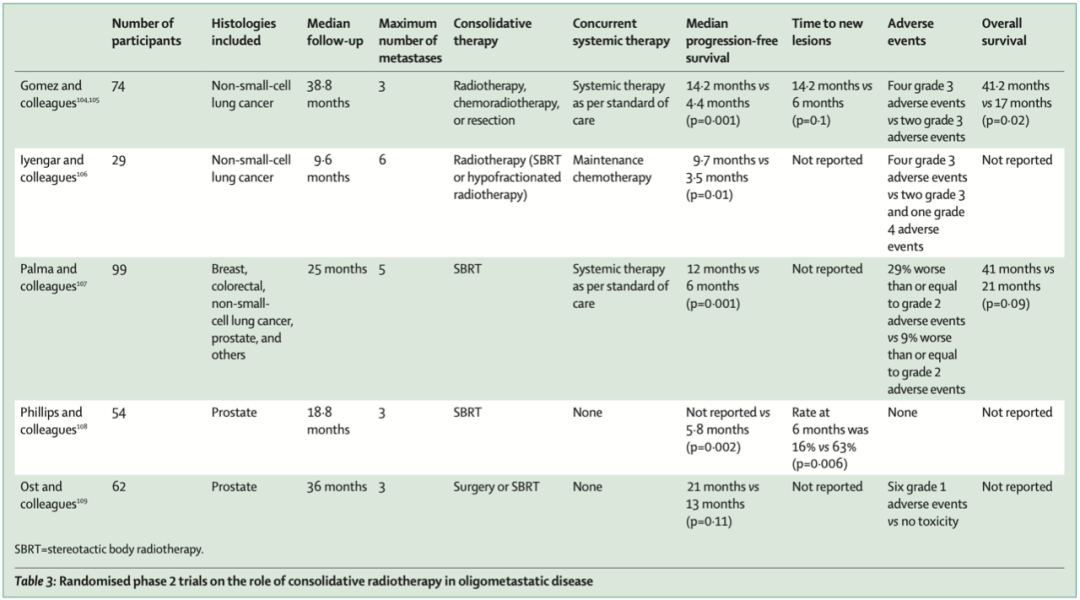
巩固治疗在寡转移疾病中的作用相关研究
综上所述,未来某些类型的癌症或可以作为慢性疾病进行治疗,定期使用SBRT,一些转移癌患者可获得治愈的机会。定义寡转移疾病存在一定困难,除了转移的位置数量之外还需要评估多个因素。欧洲放射肿瘤学学会和美国放射肿瘤学学会的联合共识,讨论了转移的位置、局部治疗的可行性、系统治疗的选择等,这些因素在治疗中都应加以考虑。
立体定向放疗和SBRT可用于姑息治疗,已在骨转移患者中表现出良好的镇痛效果,此外,SBRT已经成功应用于良性肿瘤和非肿瘤治疗,如难治性室性心动过速和其他心律失常等,这表明在肿瘤学之外也有应用前景。
存活率的提高:再照射
癌症患者存活率的提高导致了再照射相关问题的增加。在未经放疗的病人中,剂量限制和相应的毒性是相对确定的。对于再照射,数据的缺乏限制了指南和剂量限制的确定,目前指导再照射的临床决策和确定累积耐受剂量,都基于小的队列和共识。是否进行再照射取决于多种因素,包括既往放疗的总剂量、再照射的预期剂量和放疗疗程之间的时间间隔、再照射的目的、是否有毒性更低的替代治疗方案等。
了解放射生物学原理有助于理解器官的剂量耐受概念。器官一般分为串联器官和并联器官。串联器官牺牲一小段结构就会失去功能,如脊髓。其他器官,如肝脏或肾脏等,特定比例的器官实质(或功能亚基)被移除后,还可以保持器官功能。研究显示,重新照射脊髓应考虑累积剂量、每个疗程的剂量和治疗之间的时间间隔。
目前单次或多次SBRT常用于常规分割放疗后椎体转移的再治疗。对于局部复发的直肠癌,再照射或许能实现根治性切除,提高长期生存率。局部复发的肺癌和头颈部癌,也可考虑再照射。与初次放疗相比,再照射风险增加,应在肿瘤治疗效果与治疗相关毒性中取得平衡。
新治疗的成本和收益
在过去的几十年里,放疗技术迅速发展,在高收入国家中许多新的放疗方法已有临床应用。这些进步在减少毒性并改善患者的预后的同时,也增加了经济成本。成本效益研究可客观量化这些治疗的益处。例如,对于患有髓母细胞瘤的儿科患者,质子束治疗与智商下降、听力丧失、生长激素缺乏、冠状动脉疾病和继发性恶性肿瘤的发病率下降有关。
低分段和立体定向放疗技术需要比常规放疗更先进的图像引导,这需要更多的资源,但也显示了积极的成本效益结果。在Markov模型中评估了SBRT和肺叶切除术治疗早期肺癌的成本,结果表明SBRT比手术有更高的成本效益。
MRI引导放射治提高了目标可视化水平,提高了准确性,可以保留更多的健康组织。但MRI引导放疗比CT引导放疗成本更高。随着技术的不断改进,成本可能有所降低,但仍然较昂贵。未来的研究应进一步确定MRI引导放射治疗的适应证。
高收入国家的这些快速创新导致不同发展水平国家之间的差距不断扩大,一些低收入和中等收入国家的放射治疗设施不足。在世界范围内,估计只有40% – 60%的癌症患者可以使用放疗设施,需要为低收入和中等收入国家的癌症患者提供放疗,以改善患者的治疗结果。
即使在高收入国家,放射治疗设施也往往集中在城市。对于生活在偏远地区的人来说,由于路途遥远,需要每天通勤进行治疗,接受放疗有一定困难。扩大放疗的可及性有助于患者从放疗和技术进步中获益。
放射肿瘤学的未来
正如本综述所讨论的,放疗的进展有助于个性化放疗的发展,有助于器官保存,增加非肿瘤性疾病等新适应证,提高粒子治疗的应用,辅助免疫治疗。未来几年,放射治疗的技术将继续进步。
超高剂量率放射治疗(FLASH)、治疗性纳米颗粒作为放射增敏剂等具有巨大发展潜力。液体活检、循环肿瘤DNA生物标记物、人工智能等的发展,为评估患者疾病负担提供了新的工具,有助于个性化治疗方法的普及。这些进展给我们的领域带来了巨大的希望。
在治疗期间和治疗后,提高对患者的照护对患者的生活质量和预后也非常重要。虚拟现实等技术已经起到了一定的辅助作用。例如,放射治疗环境模拟系统可作为放疗的模拟器,培训工作人员的同时增加病人的经验,患者的反馈也有助于更好地理解癌症治疗的身体、情感和社会副作用。随着预后和生存期的持续改善,继续随访评估所有肿瘤治疗的长期效果利于患者的生活质量最大化。
目前COVID-19极大地影响了全球目前和未来癌症患者的护理。尽管远程保健、低分割和远程管理的发展在未来可能会使患者受益,这一时期可能会对患者的诊断和治疗以及正在进行的临床试验产生长期影响。我们需要共同努力克服这些挑战,确保患者的预后的改善。
来自: 奇点肿瘤探秘