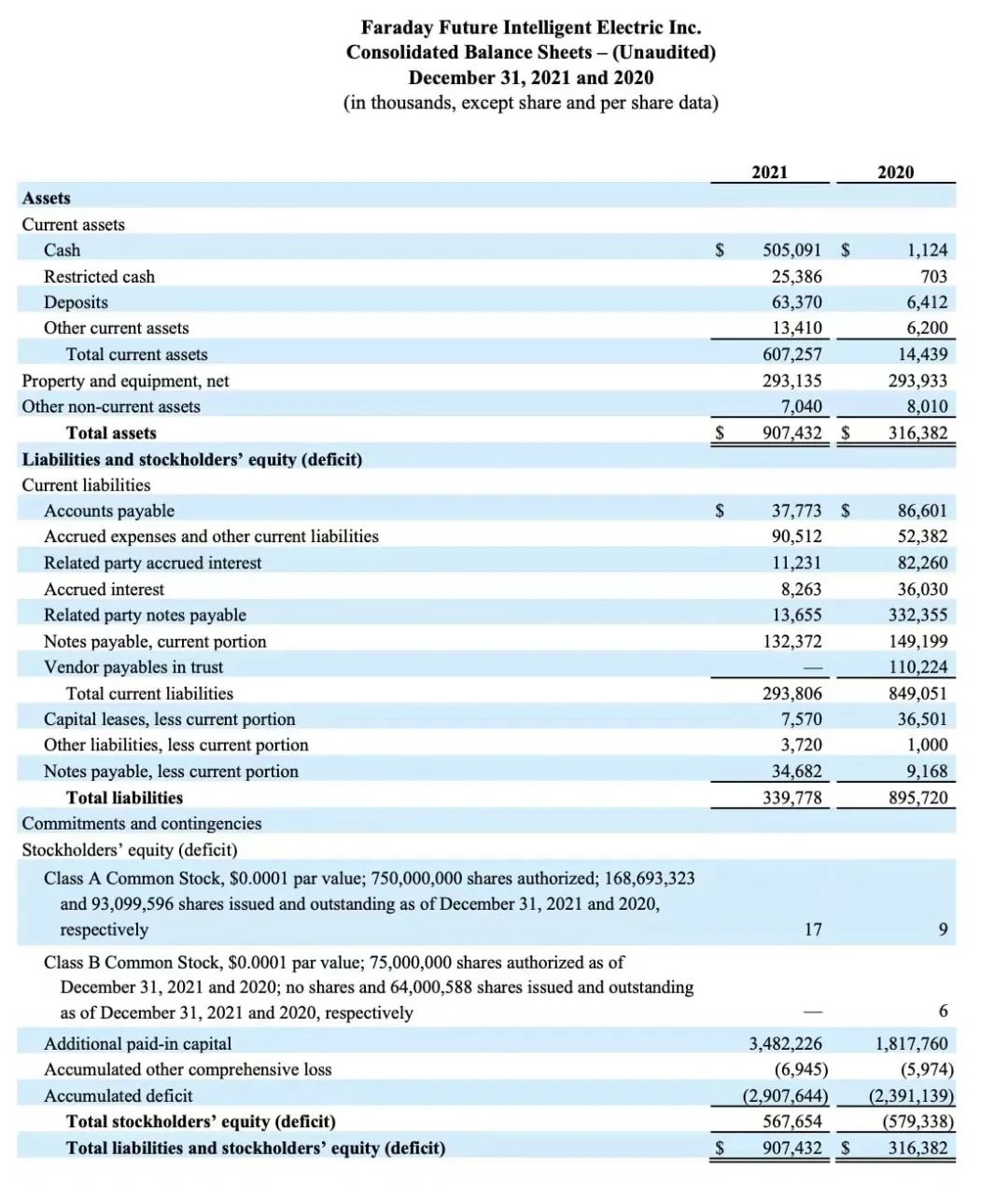
表面带有Fas配体的微凝胶显微图像
本报讯 将胰腺细胞与释放蛋白质的微凝胶一起移植到患有Ⅰ型糖尿病的猴子身上,可以改善其血糖控制,并且移植的细胞不会被排斥。相关论文5月13日发表于《科学进展》。
为调节血糖,Ⅰ型糖尿病患者必须注射胰岛素,因为其免疫系统会错误地攻击胰腺中的胰岛β细胞,而后者会产生降糖激素胰岛素。移植胰岛β细胞能使Ⅰ型糖尿病患者自己产生胰岛素,但后者需要终生服用免疫抑制药物以防细胞被排斥。这会削弱患者的免疫系统,使其面临更大的感染和癌症风险。
为寻找另一种治疗方法,美国哈佛医学院的季磊(音译)和同事给7只猴子注射了一种名为链脲佐菌素的天然药剂,这种药可以杀死胰岛β细胞,从而诱发Ⅰ型糖尿病。12天后,科学家从健康猴子身上取出胰岛细胞并与微凝胶混合。这些细胞和微凝胶随后被移植到猴子腹部的组织层中。
其中4只猴子接受了填充Fas配体(FasL)的微凝胶—— 一种能够杀死过度活跃免疫细胞的天然蛋白质,以及一种名为链霉亲和素(SA)的蛋白质,它可以将FasL“粘”到微凝胶上。这些凝胶预先与胰岛细胞混合,可以在体内缓慢释放FasL到移植细胞中,防止后者被排斥。
剩下的3只猴子接受了胰岛移植,以及没有FasL或SA的“空”微凝胶。所有的7只猴子在前28天都接受了补充胰岛素,以及为期3个月的抗排斥药物雷帕霉素治疗。
研究人员称,在接下来的6个月里,接受SA-FasL微凝胶移植的猴子产生的胰岛素水平与它们患糖尿病之前相同,至少在空腹时是这样。猴子的餐后胰岛素分泌正常,为80%~90%,所以它们只是偶尔需要少量补充胰岛素。
“这些猴子的肝肾功能也正常,表明这种治疗是安全的,没有移植排斥的迹象。”季磊说,“通常我们必须进行非常积极的治疗和使用多种药物,但在这种情况下,我们没有这样做。”
在没有SA-FasL情况下接受微凝胶移植的猴子,在手术后几周内对胰岛移植产生了排斥反应。论文合著者、密苏里大学的Haval Shirwan说,他们的目标是有朝一日为医院提供一种“现成的技术”,允许外科医生在胰岛移植的同时植入这种微凝胶。他希望人体试验能在两年内开始。(李木子)
相关论文信息:
https://doi.org/10.1126/sciadv.abm9881