充足且连续的睡眠不仅能让我们精神饱满地迎来一天的生活,还对健康的方方面面起到促进作用。相反,睡眠质量不佳可能导致免疫力下降、认知衰退、肥胖、心血管疾病等一系列问题。
道理虽然简单,但对很多人来说,良好的睡眠却遥不可及。尤其是随着年龄增长,很多人会受到睡眠问题的困扰。其中一个普遍存在的问题是睡眠碎片化——无法一觉睡到天亮,而是在夜间多次短暂地醒来。

我们注意到,临床上早已观察到老龄化过程中睡眠碎片化的现象,并且这一现象在啮齿类动物和果蝇等其他物种中也有报道,但文献中还未查阅到这一现象背后的清晰机制。”斯坦福大学的李世斌博士介绍道。
在一篇发表于《科学》的最新论文(李世斌博士为第一作者)中,斯坦福大学的Luis de Lecea教授领导的研究团队揭开了睡眠碎片化的一个神经机制,并且提出了潜在的治疗思路。

这项研究关注的对象是下丘脑泌素(Hcrt,也称食欲素)神经元。之前的研究已经发现,位于下丘脑外侧区域的Hcrt神经元与觉醒密切相关:这类神经元活跃时,它们能促使睡眠到觉醒状态的转化,并维持觉醒状态。相反,严重的Hcrt神经元的丧失可能导致罕见的I型发作性睡病:患者情绪受到刺激时,即使是在清醒状态下,也可能会不受控制地突然昏倒,进入一种类似睡眠的状态。
基于Hcrt神经元在促进睡眠-觉醒转换以及维持觉醒中的作用,研究团队猜测:老龄化过程中的睡眠碎片化,很可能与这类神经元的活动改变有关。
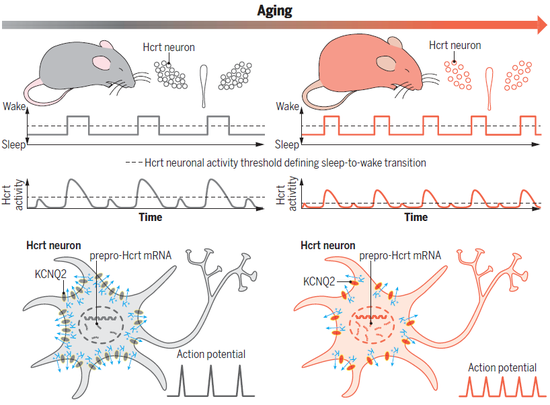
为了验证这个猜想,研究团队首先对比了不同年龄小鼠的睡眠情况。他们注意到,相比于年轻小鼠,年老小鼠出现了睡眠碎片化的现象,这提示在不同物种间,睡眠碎片化可能有着相似的保守神经机制。而在对小鼠的进一步研究过程中,两条看似相悖的线索出现了。
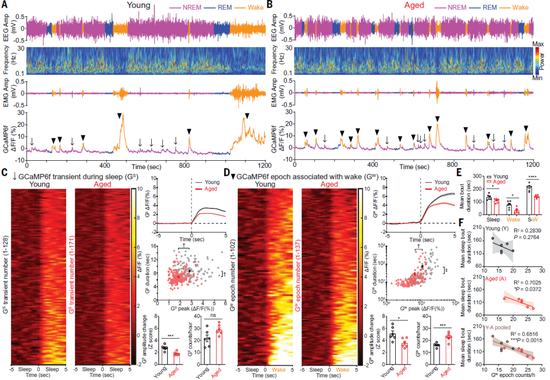
一方面,在体钙成像的结果显示,年老小鼠的Hcrt神经元活动频率更高,它们更容易从睡眠进入觉醒状态,睡眠持续的平均时长更短。另一方面,在体光遗传学研究显示,尽管年老小鼠表达光敏通道(ChR2)的Hcrt神经元数量更少,但老年小鼠的Hcrt神经元被激活后,觉醒状态的持续时间比年轻小鼠更长。
此外,小鼠全脑切片实验对Hcrt神经元进行定量分析显示,年老组多达38%的Hcrt神经元丢失了。
要知道,Hcrt神经元的作用是促进从睡眠状态中觉醒,那么随着神经元数量减少,睡眠状态应该更持久、稳定才对。然而,实际观测情况却恰恰相反。是什么机制,让年老小鼠用更少的Hcrt神经元,导致了更多的觉醒次数呢?
借助离体电生理实验,研究团队在细胞层面找到了答案。年老小鼠的Hcrt神经元静息电位更高,或者说更接近放电的阈值。因此,稍加刺激,这些神经元就会进入放电状态;相比之下,年轻小鼠的Hcrt神经元需要更强的刺激,才会进入兴奋状态、开始放电。
因此,在老龄化过程中,Hcrt神经元转变为超兴奋状态,正是这样的变化导致年老小鼠更容易从睡眠状态中觉醒。那么,又是什么原因导致了年老Hcrt神经元的高兴奋性呢?
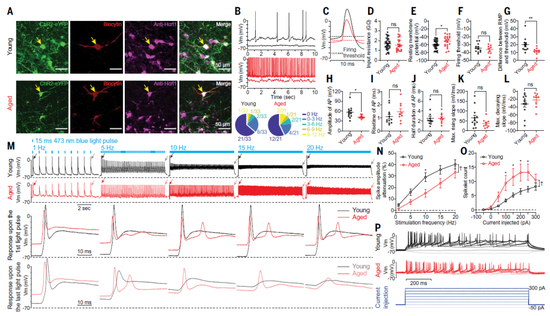
在神经元动作电位的复极化及维持神经元静息状态的过程中,电压门控钾离子通道(KCNQs)扮演着关键角色。这类通道可以将带正电的钾离子从细胞内泵到胞外,从而增大细胞膜内外的电位差,神经元因此更容易保持静息状态。
李世斌博士表示:“因此我们在想,或许在衰老过程中,由于氧化或其他因素,钾离子通道的表达量下降,从而导致年老Hcrt神经元的膜电位去极化,因而更容易被激活。”
基于这样的考虑,研究团队对这类通道进行了分析。在年老小鼠中,KCNQ2/3介导的电流更弱;同时,高分辨率成像显示,它们Hcrt神经元中KCNQ2的表达密度更低。这些结果说明,KCNQ2/3通道介导的复极化电流下调导致年老Hcrt神经元具有高兴奋性,进而引起睡眠碎片化。
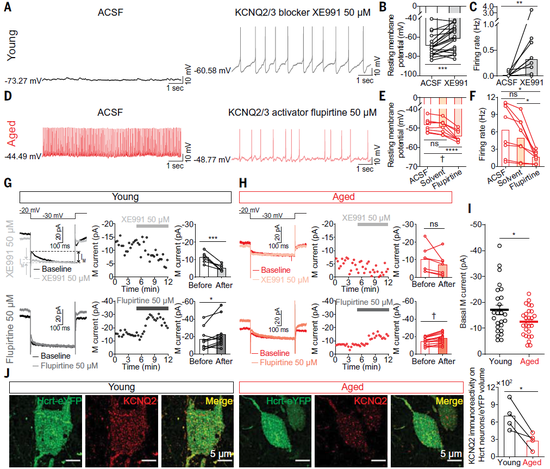
随后,研究团队利用基因编辑工具验证了这个结果:他们破坏了年轻小鼠中的Kcnq2/3基因,这时它们会出现与年老小鼠类似的睡眠碎片化。
基于上述神经机制,研究人员使用药理学方法增强KCNQ2/3介导的复极化电流。KCNQ2/3的激动剂氟吡汀(Flupirtine)使得年老Hcrt神经元的静息电位更加极化、动作电位发放频率降低,也使得年老小鼠睡眠状态也更加稳定。这项实验说明,通过药理学方法增强KCNQ2/3所介导的复极化电流,有望为那些遭受低睡眠质量困扰的人找到新的治疗方案。
值得一提的是,氟吡汀曾被欧盟批准作为非鸦片类镇痛剂,而这种药的副作用之一就是嗜睡。由于发现具有肝脏毒性,氟吡汀的上市许可此后被撤销。如果能寻找到毒副作用更小的全新的KCNQ2/3激动剂,未来我们可以期待沿着这一思路开发出改善睡眠质量的新药。
对于这项研究,李世斌博士点评道:“这项研究最重要的一点在于,我们找到了老龄化过程中出现睡眠碎片化的一个机制。当然,这可能不是全部机制,但鉴于这个清晰的机制,或许可以对症下药、有针对性地开发相关疗法。”
目前,对于睡眠碎片化的人群——无论是年轻人还是年老的病人,医生往往会不加区分地使用促睡眠药物。但实际上,对于不同人群,导致睡眠问题的机制可能是不同的。在这项研究的基础上,未来对于老年人睡眠障碍的治疗,有望迎来全新的思路。
参考资料:
[1] Shi-Bin Li et al。, Hyperexcitable arousal circuits drive sleep instability during aging。Science(2022) https://doi.org/10.1126/science.abh3021
本文来自药明康德内容微信团队