今天,分享一篇复旦团队发现20余种新型同源蛋白,能高效精准修复致病突变,助力开发差异化的碱基编辑器,希望以下复旦团队发现20余种新型同源蛋白,能高效精准修复致病突变,助力开发差异化的碱基编辑器的内容对您有用。
来源:DeepTech深科技
“我们的研究提供了一种新的脱氨基酶筛选方案,为碱基编辑器的构建带来了更多选择。一方面突破了腺嘌呤碱基编辑器脱氨基酶底层专利的限制,也为差异化碱基编辑器工具开发奠定了基础。”复旦大学脑科学转化研究院程田林研究员表示。
最近,他和团队发现:20 多种新型 TadA 同源蛋白在经过简单改造之后,可被用于腺嘌呤碱基编辑器 ABE、胞嘧啶碱基编辑器 CBE 以及兼具两者功能的 ACBE 的构建。针对这 20 多种新型 TadA 同源蛋白,课题组均已申请了技术发明专利。

在应用前景上,借助这项成果可以开发更多差异化的、具有不同碱基编辑特性的碱基编辑器,从而实现遗传病的个体化精准治疗。
在疾病治疗和临床应用上,碱基编辑器必须具备高效、精准和安全等特征。从特定角度来讲,精准和安全可谓是一体两面:足够的精准,便意味着足够安全。
实际上,药物研发乃至各类治疗策略的研发,都是基于以下两个思路:一是“包治百病”的普适性疗法;二是“因人而异”的个体化精准疗法。
基因编辑乃至于碱基编辑器的开发,同样存在着这两种思路:思路之一是一种碱基编辑器“打天下”,只用根据致病位点改变 gRNA 即可;思路之二是根据不同的疾病位点,来调整碱基编辑器和 gRNA 的组合,而且最好是一种组合仅在特定的致病位点上有效。
在此次研究里,程田林团队筛选出多种脱氨基酶,也开发出多种碱基编辑器。毫无疑问,这将助力于开发差异化的碱基编辑器,进而推动个体化精准治疗的实现。
 (来源:Nature Communications)
(来源:Nature Communications)
亟需能高效精准修复致病突变的基因组编辑工具
从生物学和还原论角度来讲,人体是众多细胞的有机组合体,人体健康离不开细胞的正常运转。细胞正常运转与否的根本,在于细胞内遗传物质基因组 DNA 的正确与否。
对于遗传、蛋白质编码以及生命过程来讲,DNA 和其编码的基因所提供指令是必不可少的。很多疾病特别是遗传病的根源就在于 DNA 及其编码的基因发生了突变。
因此,从遗传的角度而言,如能实现致病突变的原位精准修复,理论上将可以根治多种疾病。
基因编辑技术,是实现致病突变原位精准修复的有力武器,学界已有大量相关研究正在推进中。在基因编辑技术中,最具代表性的就是 CRISPR-Cas9 系统,这一系统给基因编辑研究带来了革命性突破,让基因编辑效率和精准度产生了质的飞跃。
不过,经典的 CRISPR-Cas9 系统依然存在缺陷:它能以极高的效率破坏 DNA 序列的完整性,但是精准修复 DNA 序列的效率却比较低。
因此,要想更好地治疗遗传疾病,亟需开发一款可以高效精准修复致病突变的基因组精准编辑工具。
2016 年以来,美国哈佛大学教授David Liu 实验室将碱基脱氨基酶与 CRISPR-Cas9 系统组合,开发出可介导单碱基点突变的新型基因组精准编辑工具——碱基编辑器(base editors)。
碱基编辑器的核心组分,分别是 Cas9 核酸酶和碱基脱氨基酶。根据碱基脱氨基酶的不同,碱基编辑器又分为胞嘧啶碱基编辑器(Cytosine base editor,CBE)和腺嘌呤碱基编辑器(Adenine base Editor,ABE)。
其中,CBE 中的碱基脱氨基酶是——胞嘧啶脱氨基酶,它可以介导碱基胞嘧啶 C 突变为胸腺嘧啶 T(即 C>T 突变);
ABE 中的脱氨基酶是——腺嘌呤脱氨基酶,它可以介导碱基腺嘌呤 A 突变为鸟嘌呤 G(即 A>G 突变)。
由此可知,CBE 和 ABE 是一类基因组精准编辑的工具,可以实现基因组目标位点 C>T 或 A>G 的单碱基点突变。
可介导单碱基点突变的基因组精准编辑工具的重要价值在于,在人类的致病遗传变异中,单碱基点突变的占比接近 60%。单就 C>T 和 A>G 点突变而言,其在人类致病遗传变异中的占比也达到 35%。
这意味着在人类遗传病治疗中,CBE 和 ABE 具备非常广阔的应用前景,相关研究也一直热度不减。不过随着相关课题的推进,研究人员发现 CBE 和 ABE 在包括编辑活性、编辑窗口、序列的偏好性以及安全性在内的多个方面,依然存在一些缺陷与不足。
作为碱基编辑器的核心组分之一,对于 CBE 和 ABE 介导 C>T 和 A>G 突变的编辑活性、编辑窗口以及序列的偏好性来说,碱基脱氨基酶都会给它们带来重要影响。
以 CBE 为例,好几种胞嘧啶脱氨基酶都能用于构建功能性 CBE,比如人源 AID(activation-induced cytidine deaminase)、人源 APOBEC3A、大鼠源 APOBEC1、以及七鳃鳗源 PmCDA1、LjCDA1 等。
不同类型胞嘧啶脱氨基酶所构建的 CBE,在目标位点的编辑活性、编辑窗口以及序列偏好性各不相同。
不同种类胞嘧啶脱氨基酶所带来的独特的碱基编辑特性,有着非常重要的意义,它能帮助科学家开发出差异化的 CBE 工具,从而解决 CBE 在编辑活性、编辑窗口以及序列的偏好性等方面的不足,进而更好地解决各类致病遗传变异,在治疗更多遗传病的同时,还能实现个体化的精准治疗。
就临床应用而言,编辑活性、编辑窗口、以及序列偏好性等问题,会给可被治疗的疾病种类和数量带来一定影响,同时还会伴随致命的安全风险。如今,经典的 CRISPR-Cas9 系统已被用于临床治疗研究,不过其安全风险已经是相对可控的。
与经典的 CRISPR-Cas9 相比,CBE 和 ABE 拥有额外的脱氨基酶组分,那么这种组分是否会导致额外的安全风险?
研究发现,由于胞嘧啶脱氨基酶对于单链 DNA 具有亲和力,CBE 会导致严重的 DNA 脱靶风险,即当 CBE 位于基因组目标位点之外的区域时,会导致 DNA 发生突变。
而由于腺嘌呤脱氨基酶对 RNA 具有亲和力,所以 ABE 会带来严重的 RNA 脱靶风险,也就是 ABE 会导致 RNA 的突变。
为解决 CBE 和 ABE 的脱靶风险,学界对脱氨基酶组分进行了一系列的蛋白质工程改造研究,一定程度上解决了 CBE 和 ABE 在 DNA/RNA 水平的脱靶风险。
不过,由于 CBE 导致的 DNA 脱靶会带来永久性的基因组损伤,其安全风险尤为值得关注。
尽管针对胞嘧啶脱氨基酶的蛋白质工程化改造,在很大程度上解决了 CBE 工具 DNA 脱靶引起的安全风险,但同时也限制了 CBE 的编辑活性、编辑窗口以及序列偏好性。
鉴于胞嘧啶脱氨基酶是导致 DNA 脱靶的核心因素,曾有课题组尝试开发胞嘧啶脱氨基酶的替代品,以从根本上解决 CBE 导致的 DNA 脱靶风险。
胞嘧啶脱氨基酶替代品的发现,源自对于 ABE“副作用”的研究:研究者注意到 ABE 表现出一定的 CBE 活性,即除了介导 A>G 突变之外,在某些特定的位点上还能介导 C>T 活性。
这说明用于 ABE 构建的腺嘌呤脱氨基酶组分,或许具备被改造的可能,并有希望用于 CBE 的构建。考虑到 ABE 在 DNA 水平的高安全性,这样改造而来的 CBE 有望突破 DNA 脱靶的困扰。
多年来,程田林课题组一直致力于新型基因编辑技术的研发,尤其关注基因组精准编辑工具研究。
包括该团队在内的国内外多个实验室均已发现,通过蛋白质工程改造,可以实现腺嘌呤脱氨基酶的重编程。重编程后的腺嘌呤脱氨基酶突变体,可以构建出低 DNA 脱靶风险的 CBE。
对于 CBE 的构建来说,这也是一条新的思路。同时也意味着,腺嘌呤脱氨基酶在碱基编辑器领域有着独特且关键的地位,它不仅是构建 ABE 的关键,也是构建高安全性 CBE 的关键。
然而,目前存在的待解问题之一是:自然界中存在多种可编辑 DNA 的天然胞嘧啶脱氨基酶,它们都能被用于构建 CBE。然而,对于 ABE 来说自然界里却缺少相应的天然腺嘌呤脱氨基酶。
为此,美国哈佛大学David Liu 实验室通过蛋白定向演化策略,对大肠杆菌来源的腺嘌呤脱氨基酶 TadA(ecTadA)进行多轮改造,最终获得了可以编辑 DNA 的 ecTadA 突变体,并构建出了高活性的 ABE。
由于 ecTadA 的改造过程过于复杂,需要在 10+位点同时引入点突变才能改造成功。截止目前,依旧没有科研团队去尝试改造其它的腺嘌呤脱氨基酶。
也正因此,现有的各类 ABE 工具乃至由 ABE 重编程而来的高安全性 CBE 中的脱氨基酶组分,均为 ecTadA 突变体。
这会导致多个问题:
一是 ABE 核心组分——脱氨基酶的底层专利属于美国;
二是 ABE 核心组分脱氨基酶,都源自于大肠杆菌的 TadA 蛋白,很有可能会限制差异化 ABE 工具的研究;
三是通过腺嘌呤脱氨基酶重编程开发的高安全性 CBE,需要在前期 ecTadA 复杂改造的基础上继续进行改造,并且同样面临底层专利受限以及工具差异化研究受限的难题。
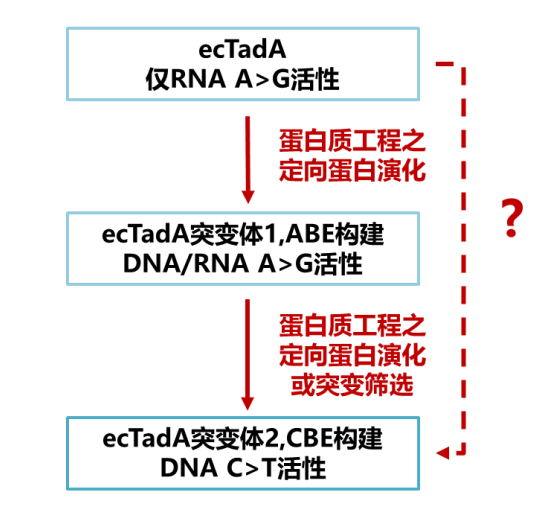 图 | ecTadA 改造和碱基编辑器构建(来源:资料图)
图 | ecTadA 改造和碱基编辑器构建(来源:资料图)因此,对于研发碱基编辑器来说,设计新的腺嘌呤脱氨基酶改造和筛选策略,在 ABE 和 CBE 的开发中都是至关重要的。
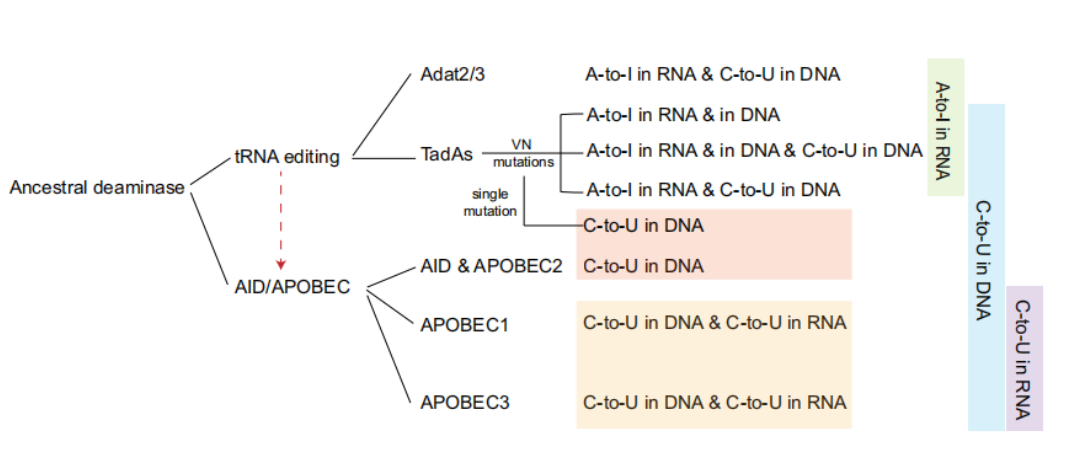
此外,这背后还涉及到更深层的科学问题:胞嘧啶脱氨基酶 AID/APOBEC 蛋白家族和腺嘌呤脱氨基酶 TadA 蛋白家族两者之间是否存在演化关系?虽然有研究提示 AID/APOBEC 可能起源于 TadA,但是仍然缺少足够的证据支持。而 TadA 兼具构建 ABE 和 CBE 的潜力,或许能为两种脱氨基酶的演化关系提供更多证据。

构建更具特色的碱基编辑器
程田林课题组通过研究发现,与传统的末端融合相比,通过 Cas9 内部融合构建的 ABE 具有更高的活性。而且在内部融合的基础上,ecTadA 仅需经过双保守位点的简单改造,就能获得高活性的 ABE。相比传统 10+位点的同时突变,这是一个巨大的进步。
为此,他和团队通过内部融合策略,并结合双保守位点突变的蛋白质工程改造,筛选出 20 多种全新的 TadA 同源蛋白突变体,并将它们用于碱基编辑器构建。
更重要的是,这种全新的筛选策略、尤其是双保守位点突变这样一种简单的蛋白质工程改造策略,不仅可以构建 ABE、还能构建出 CBE 和 ACBE。
这种新筛选策略的意义在于,打破了腺嘌呤脱氨基酶 TadA 改造的“枷锁”,为碱基编辑器 ABE 和 CBE 的构建提供了更多可能。
从蛋白演化的角度来说,本次工作也提供了更多证据,支持了 AID/APOBEC 可能起源于 TadA 的这一假说。
 (来源:Nature Communications)
(来源:Nature Communications)程田林表示,基因编辑研究课题的开展,关键在于切入点的寻找。2019 年,他就已经注意到相比传统的末端融合,Cas9 内部融合策略构建的 ABE 活性更高。
其中,Cas9 内部的 DS1249 位点融合 ecTadA 突变体后,不仅表现出最强的 ABE 活性,还能表现出一定的 CBE 活性,相关论文已于 2020 年发表在 Nature Communications。
而考虑到 DS1249 位点融合对于碱基编辑器活性的增益效果,他和团队一直在探索是否能将 DS1249 位点融合,用于开发新型 CRISPR-Cas9 的衍生工具。
另据悉,ABE 研究的“开山之作”来自上文的 David Liu 团队,而 ecTadA 改造的核心点突变是 A106V 和 D108N 双点突变,这两点突变代表着“0 到 1 的改变”,它让 ecTadA 真正具备了编辑 DNA 的能力。
不过,仅仅凭借 A106V 和 D108N 双点突变的 ecTadA 突变体所构建的 ABE,在人源细胞中生成的 A>G 编辑活性非常低,需要经过多轮优化和更多点突变的引入之后,才能构建出高活性的 ABE 工具。
考虑到 Cas9 的 DS1249 位点融合,可以显著提升碱基器的活性。因此,程田林将内部融合策略与 ecTadA(VN)突变体互相结合,以此来探索内部融合对于相应 ABE 活性的影响。
结果证实,通过 DS1249 位点融合、结合 ecTadA(VN)所得到的 ABE 变体,表现出特别高的 A>G 活性,突变率超过 80%;并表现出明显的 C>T 活性,突变率接近 30%。
这也让课题组更有信心开启新的课题。在自然界的原核生物中,几乎都有 TadA 同源蛋白存在,其数量高达几千种之多。作为新成立的实验室,程田林团队无法对多达上千种的 TadA 同源蛋白进行高通量筛选,否则单 TadA 蛋白合成的成本可能高达数十万元。
此外,尽管通过内部融合来结合双点突变,可以让大肠杆菌来源的 ecTadA 构建出高活性的 ABE。但是,这一策略是否适合于其它物种来源的 TadA,依旧是一个未知数。
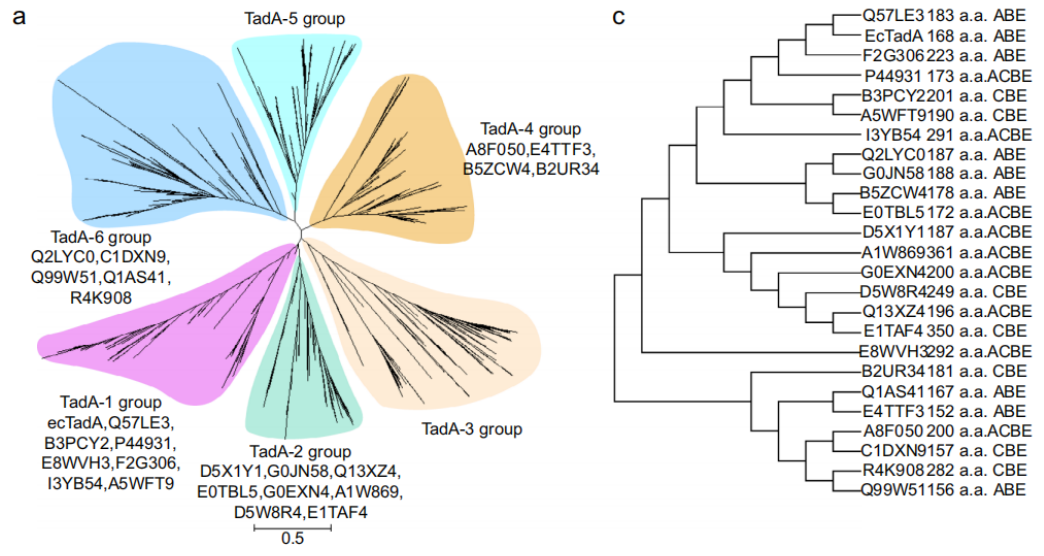
如何从上千种蛋白中挑选出有代表性的 TadA 同源蛋白?该团队的策略是通过进化树分析的方法,来对 TadA 同源蛋白进行分类。
然后,根据进化距离和序列的相似度,挑选出进化距离较远、且序列相似度较低的蛋白,以尽可能覆盖所有可能的 TadA 同源蛋白类型,从而检测其用于构建碱基编辑器的可行性,并探索构建差异化碱基编辑器的可能。
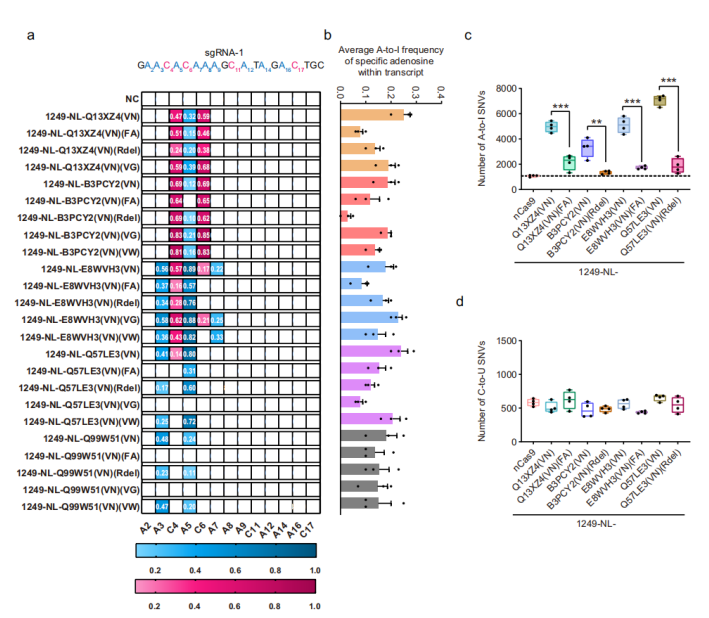
最终,他们挑选出 54 种 TadA 同源蛋白,通过 DS1249 内部融合,以及对应于 ecTadA 蛋白的 A106V 和 D108N 的单/双点突变,对构建碱基编辑器进行了功能验证。
结果发现,除David Liu 团队报道的大肠杆菌 ecTadA 之外,至少还有 24 种 TadA 同源蛋白,可以通过 N 或 VN 突变进行工程化改造,从而生成功能性碱基编辑器。
在这些 TadA 同源蛋白里,8 种主要表现为 ABE 活性,9 种具有明显的 ABE 和 CBE 的活性,7 种主要表现为 CBE 活性。
程田林说:“这一结果让人非常意外,我们没想到会有多达 7 种 TadA 同源蛋白通过简单的双点突变改造,就能直接构建高活性的 CBE 工具。”
同时,结合已有的关于 TadA 家族蛋白与 AID/APOBEC 家族蛋白的演化关系,这一研究也为 AID/APOBEC 可能起源于 TadA 这一假说提供了相当扎实的证据。
 (来源:Nature Communications)
(来源:Nature Communications)事实上,考虑到 ABE“开山之作”中 ecTadA 改造的困难程度,针对 TadA 同源蛋白进行筛选和改造的做法,课题组一直有所畏惧。
他们曾尝试将 ecTadA 突变体中的 10 多个点突变,“移植”到其它物种的 TadA 同源蛋白中。然而,这 10 多个点突变对应的氨基酸位点,在其它物种中并不是完全保守的。因此,在 TadA 同源蛋白中,单纯地对保守位点进行点突变“移植”的尝试并未获得成功。
但是,在对点突变位点的保守性进行分析时,他们注意到 A106 和 D108 两个位点,在 TadA 同源蛋白中呈现出高度保守性。并且,在 ecTadA 蛋白定向演化的第一轮中,A106V 和 D108N 已经是高度富集的点突变。
基于此,在合成 TadA 同源蛋白时,课题组直接将对应于 A106 和 D108 的氨基酸突变为 V 和 N。然后,通过 DS1249 的内部融合,来对构建 ABE 进行功能筛选。
事实上,他们原本的计划是:在 A106V 和 D108N 的基础上,逐一增加其它点突变,以便在 TadA 同源蛋白中,寻找具有普适性的点突变组合。
而令人欣喜的是,只需 A106V 和 D108N 的双点突变,就足以让 24/54 种 TadA 同源蛋白构建出功能性的碱基编辑器,并且涵盖 ABE、CBE 和 ACBE 三种类型。至此,本次课题告一段落,实验室成员开始论文写作。
 图 | 程田林(来源:程田林)
图 | 程田林(来源:程田林)程田林实验室的张淑倩博士、中科院脑科学与智能技术卓越创新中心袁博博士是共同一作,程田林担任通讯作者。
复旦大学类脑智能科学与技术研究院赵兴明实验室、以及上海交通大学医学院松江研究院仇子龙实验室,也给予了大力支持和帮助。
接下来,程田林的设想是:
一是利用新设计的筛选方案继续发掘更多脱氨基酶以及其它类型的 DNA 修饰酶,以构建更具特色的碱基编辑器;二是对现有 20 多种不同物种来源的 TadA 同源蛋白,进行后续的蛋白质工程改造,以及对衍生碱基编辑器的编辑特性进行优化,并探索差异化碱基编辑器构建的可行性,以期为基因治疗奠定更多基础。
 参考资料:
参考资料:1.Zhang, S., Yuan, B., Cao, J. et al. TadA orthologs enable both cytosine and adenine editing of base editors. Nat Commun 14, 414 (2023). https://doi.org/10.1038/s41467-023-36003-3