原标题:新冠不能感染小鼠?中国团队首次发现贝塔变体能感染标准小鼠
SARS-CoV-2感染受体为人血管紧张素转化酶(hACE2),由于与hACE2存在关键氨基酸位点差异,小鼠ACE2(mACE2)不能介导病毒入侵,因此SARS-CoV-2的原始毒株并不能感染普通小鼠模型。而此前科学界用于评估抗病毒药物或医疗疗效的大SARS-CoV-2感染小鼠模型,都是基于昂贵的表达人类ACE2 (hACE2)的转基因小鼠。
最新的一项研究则发现,新出现的501Y.V2变体(也被称为贝塔变体)能够在鼻内滴注后感染标准实验室小鼠。北京时间9月4日,综合性学术期刊《国家科学评论》(National Science Review, NSR)在线发表了军事科学院军事医学研究院病原微生物生物安全国家重点实验室秦成峰研究员、中山大学有害生物控制与资源利用国家重点实验室吴仲义教授领衔完成的一项研究,题为《在SARS-CoV-2进化过程中跨物种传染性的短暂获得》(“Transient acquisition of cross-species infectivity during the evolution of SARS-CoV-2”)。

COVID-19大流行持续已近两年,在SARS-CoV-2的全球传播过程中,病毒基因组的突变逐渐积累,导致病毒变异体的出现。501Y.V1、501 Y.V2和501Y.V3(也分别被称为阿尔法、贝塔和伽马变体)相继出现,并在世界范围内广泛传播。
所有这三种SARS-CoV-2变体都包含S蛋白的特定氨基酸突变,并且在S蛋白的受体结合域(RBD)中共享一个氨基酸突变N501Y。RBD则与人细胞上的血管紧张素转换酶2(ACE2)特异性结合,介导SARS-CoV-2宿主细胞的进入。
早在去年7月,秦成峰等人在《科学》(Science)上的一项研究首次记录到,新冠病毒在小鼠体内传代过程中发生了N501Y突变,由此产生的小鼠适应株MASCp6和MASCp36完全能够感染标准实验室小鼠。这一现象显然和上述的原始新冠病毒分离毒株不同。
最重要的是,他们和其他团队一些研究也已经证明,N501Y突变显著增强了新冠病毒RBD与小鼠ACE2的结合亲和力,从而导致小鼠获得性感染和致病性表型。
然而,秦成峰等人提到,自然发生包含这种独特的N501Y突变的新冠病毒变异体(501Y.V1、501 Y.V2和501Y.V3)是否获得了感染小鼠的能力,这仍有待确定。
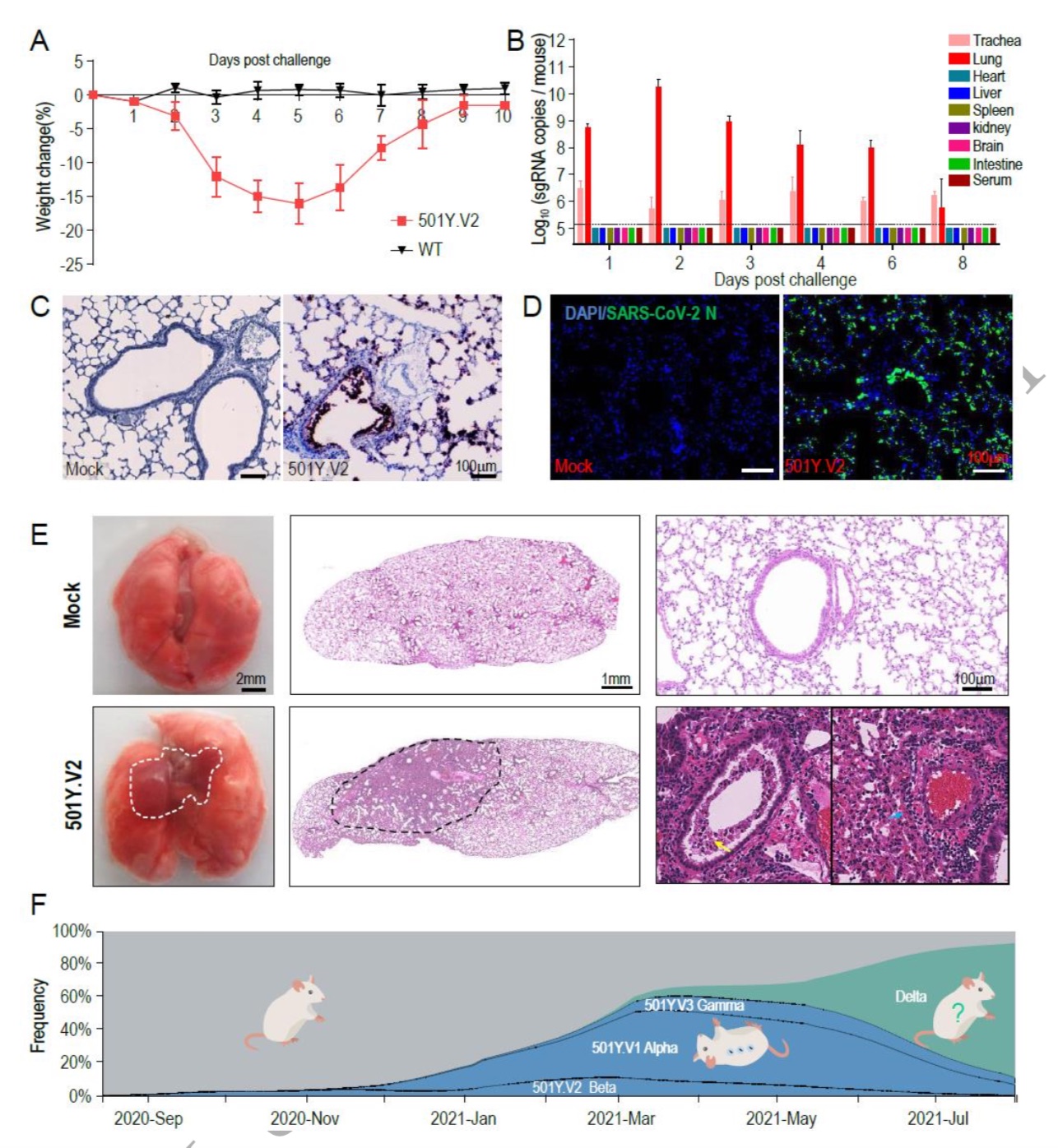
在这项最新的研究中,研究团队采用了501Y.V2变体(从一例南非输入性病例中分离),用于检测小鼠的传染性。同时以COVID-19大流行早期分离的SARS-CoV-2临床毒株IME-BJ05(野生型,WT)作为对照毒株。9月龄雌性BALB/c小鼠经鼻内注射上述不同毒株,剂量为1.2×10^4 pfu。
值得注意的是,所有501Y.V2变体感染的小鼠在感染后第3天开始出现皱毛、驼背姿势和活动减少等现象,在感染后4-6天体重也下降。这些感染小鼠最终康复,观察期间无死亡病例发生。和预期一致的是,感染原始毒株的小鼠均为出现上述现象。
为了描述病毒在小鼠中的复制动态,研究团队收集了主要组织和血清。SARS-CoV-2亚基因组RNA (sgRNA)定量显示,501Y.V2感染小鼠肺组织中病毒RNA丰度最高,在感染后的头2天有明显的增加趋势。病毒sgRNA在感染后第8天仍可在气管中检测到。然而,在其他组织或血清中没有检测到sgRNA。
采用RNAScope方法进行的原位杂交(ISH)试验显示,病毒RNA主要位于沿气道和肺泡壁的细胞中。肺切片免疫染色显示,SARS-CoV-2 N蛋白主要表达于细支气管上皮细胞和肺泡细胞。这与ISH结果一致。
研究团队还提到,更重要的是,在501Y.V2感染试验下,尸检显示小鼠有可见的肺损伤,表现为肺肿大和局部肺门周围实变。肺切片显微镜观察也显示,肺损伤主要发生在肺门周围区域,其特征是细支气管中大量脱皮坏死的上皮细胞、散在性出血,融合的肺泡壁内炎性细胞浸润。免疫组化染色显示,浸润炎症细胞主要为Neu+中性粒细胞、CD68+巨噬细胞和CD3+T细胞。
最后,在感染后第6天和第8天检测到SARS-CoV-2特异性IgG和中和抗体。
研究团队认为,综上所述,这些结果清楚地表明,501Y.V2已获得在小鼠呼吸道复制的能力,并诱导典型的肺损伤和病毒特异性免疫反应。
他们强调,这项研究提供了实验证据,即501Y.V2变种完全能够感染标准实验室小鼠。鼻内感染后,501Y.V2能导致老龄小鼠体重显著下降,501Y.V2的毒性高于小鼠适应株MASCp6,但该变体的致死率低于MASCp36。
研究团队提到,与他们此前研究的小鼠适应株MASCp6相比,501Y.V2在RBD中携带两个额外的突变(K417N和E484K)。此前的结构和亲和性分析表明,K417N和E484K突变都有助于增强小鼠ACE2的亲和性。最近的一项研究也表明,在含有N501Y、K417N和E484K突变的ACE2表达小鼠细胞中,伪型SARS-CoV-2的传染性是含有单个N501Y突变的SARS-CoV-2的4倍。而小鼠适应株MASCp36在RBD中则含有三个K417N/Q493H/N501Y突变,与小鼠ACE2的结合亲和力高于501Y.V2和MASCp6的RBD。
他们表示,实验中观察到的501Y.V2以及小鼠适应株的传染性,是与病毒RBD和小鼠ACE2之间的相互作用密切相关。此外,研究团队称,不能排除RBD之外的其他突变的影响,需要用反向遗传工具进一步验证。
他们总结称,与原始SARS-CoV-2分离毒株相比,501Y.V2以及其他带有N501Y突变的变种,显然已经获得了将其宿主范围扩展到一种新物种小鼠的能力。当然,值得提醒的是,这项实验结果是基于实验室小鼠和相对较高的攻毒剂量,尚没有证据表明501Y.V2能够在小鼠中自然传播。
值得关注的是,COVID-19以来,我们已经知道,猫、水貂、狮子和老虎中均有SARS-CoV-2检测呈阳性的案例,并且也有证据表明SARS-CoV-2在水貂养殖场中人-动物-人的双向传播。因此,研究团队提醒,有必要对野生小鼠中的SARS-CoV-2及其变异体进行分子和血清流行病学调查。
研究团队最后还提到一点,这项研究还为评估抗SARS-CoV-2的抗病毒药物和疫苗的体内疗效提供了一个更便宜和更容易获得的平台。以前大多数SARS-CoV-2感染小鼠模型都是基于昂贵的表达人类ACE2 (hACE2)的转基因小鼠,“然而,在世界范围内,几乎任何数量的实验室小鼠标准品系都很容易获得,而且相对便宜。”
研究团队认为,这种基于501Y.V2的小鼠模型将为潜在的COVID-19治疗药物和疫苗候选的体内筛选和验证打开新一扇大门。