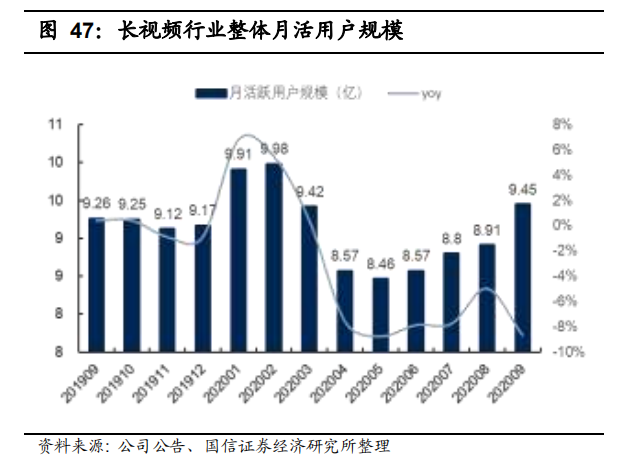
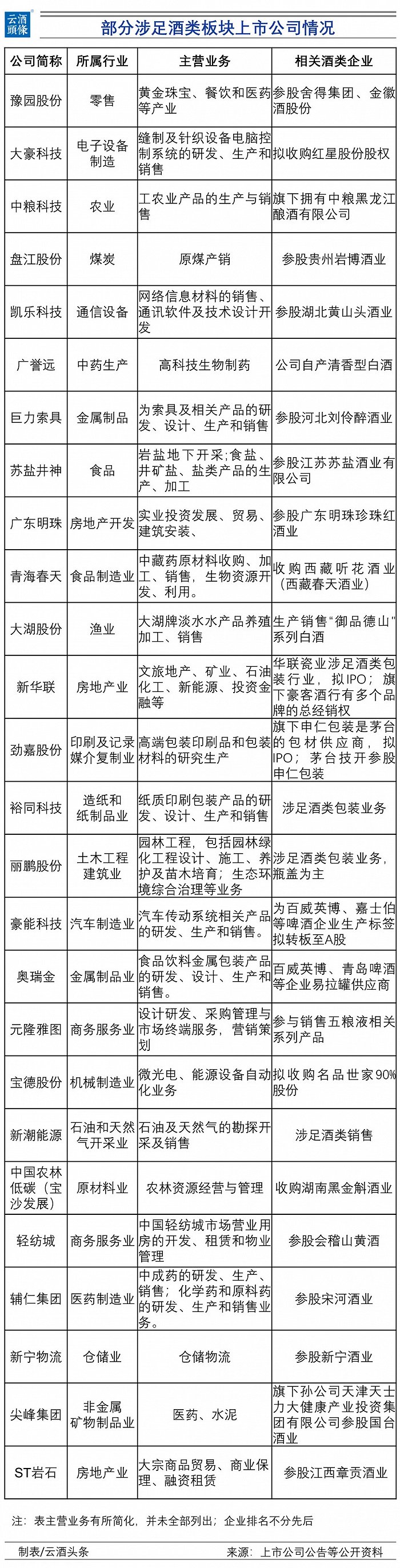
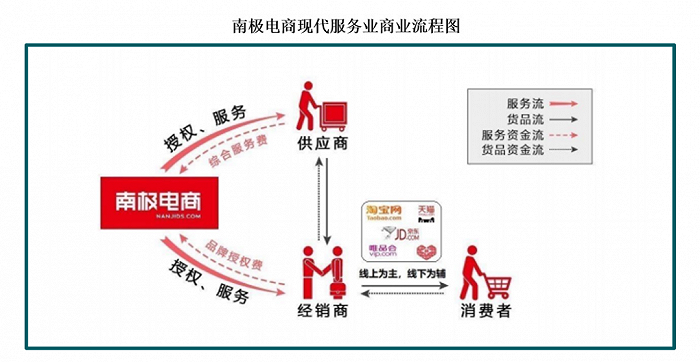
原标题:卫健委:抗肿瘤靶向药物突出基因靶点检测,需用合规伴随诊断
大健康
作者:秘丛丛
编辑:刘聪
1 分钟前
[亿欧导读]
国家卫健委连续印发《抗肿瘤药物临床应用管理办法(试行)》及《新型抗肿瘤药物临床应用指导原则(2020年版)》两份重要文件,加强抗肿瘤药物临床应用的监督管理。
 题图来自“收费图库”
题图来自“收费图库”亿欧大健康近日获悉,为规范新型抗肿瘤药物临床应用,提高肿瘤合理用药水平,保障医疗质量和医疗安全,维护肿瘤患者健康权益,国家卫健委连续印发《抗肿瘤药物临床应用管理办法(试行)》及《新型抗肿瘤药物临床应用指导原则(2020年版)》两份重要文件,加强抗肿瘤药物临床应用的监督管理。
抗肿瘤药物的应用涉及临床多个学科,合理应用抗肿瘤药物是提高疗效、降低不良反应发生率以及合理利用卫生资源的关键。抗肿瘤药物临床应用需考虑药物可及性、患者治疗意愿和疾病预后等三大要素。文件中明确规定:
1.医师应当根据组织或细胞学病理诊断结果,或特殊分子病理诊断结果,合理选用抗肿瘤药物。原则上,在病理确诊结果出具前,医师不得开具抗肿瘤药物进行治疗;
2.国家卫生健康委发布的诊疗规范、临床诊疗指南、临床路径或药品说明书规定需进行基因靶点检测的靶向药物,使用前需经靶点基因检测,确认患者适用后方可开具;
3.测所用的仪器设备、诊断试剂和检测方法应当经过国家药品监督管理部门批准,特别是经过伴随诊断验证的方法。
具体而言,在病理诊断方面,只有经过病理诊断结果确诊的恶性肿瘤,才可使用抗肿瘤药物。单纯依据临床症状、体征和影像学结果得出临床诊断的肿瘤患者,没有抗肿瘤药物治疗的指征。但是,对于某些难以获取病理诊断的肿瘤,如胰腺癌,其确诊可参照国家相关指南或规范执行。
在靶点检测方面,使用有明确靶点的药物前,必须进行相应靶点,特别是有伴随诊断产品的药物,应当使用国家批准的伴随诊断产品进行检测,不得在未做相关检测的情况下盲目用药。目前,根据是否需要做靶点检测,可以将常用的小分子靶向药物和大分子单克隆抗体类药物分为两大类。
肿瘤用药基因检测可大致分为化疗用药指导基因检测、靶向用药指导基因检测和免疫用药指导基因检测。文件对各类基因检测进行了说明:
1.化疗用药指导基因检测
通过对患者药物代谢相关基因的多态性评估,可了解化疗药物对患者的有效性或安全性(毒副作用)。目前,化疗总体有效率在30%到40%,而通过基因检测筛选出获益病人,有效率可以提高到80%。
2.靶向用药指导基因检测
靶向药物以毒副作用较小、疗效显著成为大多为肿瘤患者的首选。但是靶向药物价格昂贵,而且同一种肿瘤不同基因型患者的使用效果不同,有的疗效显著有的却毫无作用,在使用靶向药物前通过靶向用药指导基因检测,可避免患者由于盲目试药带来的经济损失及耽误治疗时间。
靶向药物涉及的主要基因及信号通路包括:
表皮生长因子受体(EGFR)
血管内表皮细胞生长因子受体(VEGFR)家族
血小板衍化生长因子受体(PDGFR)家族
成纤维细胞生长因子受体(FGFR)家族
与恶性肿瘤发生密切相关的非受体酪氨酸激酶四个家族:ABL家族、JAK家族、SRC家族以及FAK家族
与mTOR抑制剂相关的PI3K/Akt信号通路
3.免疫用药指导基因检测
常见的免疫治疗药物有PD-1/PD-L1抑制剂以及CTLA-4抑制剂,对其响应的患者可能得到长期受益,一小部分患者甚至被治愈,因此筛选出适合此类药物的患者十分必要。
评估受益的生物标记有:
① PD-L1,PD-1/PD-L1抑制剂药物只针对表达的患者,肺癌患者多选;
② MMR/MSI检测、DNA错配功能检测,两者属于同一类型检测,微卫星不稳定性(MSI)可以侧面反应MMR系统是否工作良好,结直肠癌患者多选;
③肿瘤突变负荷(TMB)。
值得注意的是,目前在国外,美国FDA强制要求用药前进行EGFR、KRAS等基因检测。另一权威机构NCCN(美国癌症综合治疗网络)已经将①EGFR、②KRAS、③ERCC1、④RRM1、⑤HER2等基因检测纳入到癌症治疗指南中。
本文来源于亿欧,原创文章,作者:秘丛丛。转载或合作请点击转载说明,违规转载法律必究。
靶向药PD-1/PD-L1