原标题:核心产品海外临床试验被暂停,康弘药业回应称因结果未达监管部门预期
 图片来源:视觉中国
图片来源:视觉中国记者 | 郑洁
编辑 | 谢欣
3月28日晚间,康弘药业发布公告称其核心产品康柏西普海外临床试验项目被法国ANSM(法国国家药品与健康产品安全局)暂停。3月29日康弘药业毫无悬念一字跌停。
根据公告,该临床试验为“一项多中心、双盲、随机、剂量范围试验评估康柏西普眼用注射液治疗新生血管性年龄相关性黄斑变性患者的疗效和安全性”临床试验项目中试验二(KHB-1802)。
康弘药业并未在公告中提及试验暂停的具体原因,而一般来说,临床试验被监管方暂停大多与其存在有效性、安全性问题密切相关,其中又以安全性问题最为常见,另外,如临床试验申办方在临床试验开展过程中存在不合规行为,如违规招募患者,也有可能被暂停试验。
3月29日下午,康弘药业方面向界面新闻记者表示,试验暂停原因为“KHB-1802实验结果没有达到法国监管部门的预期”。
康柏西普是康弘药业核心产品,据康弘药业2020年半年报,其生物制品的营业收入为4.22亿元,占营业收入比重的30.32%,而康柏西普正是康弘药业目前唯一上市的生物制品。
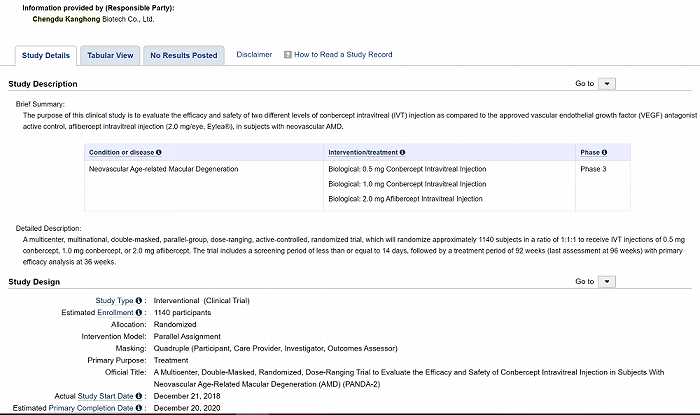
KHB-1802实验是康弘药业康柏西普全球III期临床试验的一部分,截止2020年9月25日,已完成全部受试者的第36周主要终点访视。据Clinical trials(美国临床试验注册中心)官网,KHB-1802计划入组约1140名受试者,以1:1:1的比例分组接受0.5mg康柏西普、1.0mg康柏西普和2.0mg阿柏西普的玻璃体腔注射。据康弘药业此前公告,研究的主要目标是明确0.5mg或1.0mg康柏西普是否非劣效于2.0mg阿柏西普,评估方式为采用ETDRS方法来评估第36周最佳矫正视力(BCVA)较基线的变化。主要终点是受试眼第36周ETDRS BCVA字符数得分较基线的平均变化。
新生血管性年龄相关性黄斑变性,也称为湿性年龄相关性黄斑变性,是年龄相关性黄斑变性的一种,也是导致老年人视力下降的主要原因之一。VEGF单抗是湿性年龄相关性黄斑变性的主流用药,在国内有诺华雷珠单抗、拜耳阿柏西普和康弘药业康柏西普三大产品。
长期以来,康柏西普成为康弘药业营收增长的主要贡献,但其国内市场面临两大外资巨头夹击,也不得不在价格上进行让步。2017年7月,康柏西普眼用注射液降价后纳入国家医保目录,医保支付价为5550元/支。2019年底,康柏西普获得国家医保目录续约,但也降价到4160元/支。
在此基础上,康柏西普的销售承压,康弘药业2020年半年报显示,报告期内公司生物制品营收同比下降24.51%。这种情况下,康弘药业也不得不采取“出海”策略,这才有了康柏西普的全球临床试验,
2016年9月30日,美国食品药品管理局(FDA)获批康柏西普眼用注射液在美国开展湿性年龄相关性黄斑变性III期临床试验;2018年5月,康弘药业启动在全球多中心启动该临床试验项目;2020年9月30日,康弘药业公告称,截止2020年9月25日,康柏西普眼用注射液用于治疗湿性年龄相关性黄斑变性(nAMD)的全球Ⅲ期临床试验已完成全部受试者的第36周主要终点访视。
开展全球临床试验花费不菲,为了康柏西普的“出海”康弘药业不得不求助于公开市场募资。Global Data数据显示,康柏西普眼用注射液的两款竞品阿柏西普(再生元/拜耳)和雷珠单抗(诺华)在2019年全球销售金额分别为79.79亿美元和39.24亿美元,预计2028年,nAMD国际市场规模将达到163亿美元。
2020年12月康弘药业定增募集资金总额不超过34.72亿元,扣发后将投入四个项目,其中占资最大的两个项目分别是:康柏西普眼用注射液国际III期临床试验及注册上市项目,总投资额19.20亿元,拟募投资金6.08亿元;康柏西普眼用注射液RVO(视网膜静脉阻塞)/DME(糖尿病性黄斑水肿)适应症国际III期临床试验及注册上市项目,总投资额19.69亿元,拟募投金额19.65亿元。
以上前者项目,就是康柏西普眼用注射液在北美、欧洲等国际地区开展治疗湿性年龄相关性黄斑变性(nAMD)的III期临床试验。另一个项目还未开启,但两个项目共38.89亿元总投资金额已远超康弘药业过往十余年研发支出之和,而据2020年半年报,康弘药业的境外营业收入只占比0.14%。