本文转载自公众号“NaturePortfolio"
原文作者:Elie Dolgin
2003 年是新发传染病的一个凶年。香港和荷兰,两种致命的流感病毒株从鸟类传给了人类。不仅如此,一种新的冠状病毒也开始在全球传播,还会导致名为严重急性呼吸系统综合征(SARS)的神秘疾病。许多专家都担心一场全球大流行近在咫尺。
幸运的是,最可怕的情形并没有出现。但对禽流感权威专家 Robert Webster 来说,这是一次险象环生的警告,告诫科学家和决策者一定要为下一次的疫情做准备。他的一个重要建议是:开发和储备能靶向各种病原体的药物[1]。
药物研究者没有听他的话。SARS 过去后,人们的关注也随之蒸发了——全球为此付出了代价。“科研界当初真的应该把对抗 SARS 的通用抗病毒药物开发出来,”如今是圣犹大儿童研究医院荣休会员的 Webster 说,“这样在 COVID 出现的时候,我们就能有一些储备药物了。”已知导致 COVID 的新冠病毒是 SARS 致病病毒的近亲。
 插图:David Parkins
插图:David Parkins另一则警告出现在 2012 年。当时,新冠病毒另一个近亲导致的中东呼吸系统综合征(MERS)开始在几个国家流行。这一次,可以选择的药物依旧屈指可数,诺华生物医学研究所负责人 Jay Bradner 称这个事实“令人遗憾”。
“我们应该感到羞愧,”他在提到整个制药行业时说,“我们本可以有更多准备。”
除了最早用来治疗丙肝和埃博拉的药物瑞德西韦(remdesivir)有过一次公认的成功,市面上几乎没有可以对新冠病毒进行快速测试和使用的候选抗病毒药物。研究人员因为选择稀少而惋惜不已。“我们需要一个弹药库。”波士顿 Dewpoint Therapeutics 生物技术公司发现生物学负责人、国际抗病毒研究协会会长 Kara Carter 说。
打造这个弹药库的新计划已经在酝酿中。美国国立卫生研究院(NIH)正在策划一个药物研发项目,专门针对新冠病毒变异株和其他具有大流行潜力的病毒。一个有产业背景的新联盟也将矛头对准流感病毒和冠状病毒。另外还有一些研究团队希望对构成大流行威胁的远源病原体开发抗病毒药物。
这些项目不需要从头开始。过去一年里,围绕新冠病毒的药物开发已经大量涌现。但是,制药行业在过去一向只关注少数几种特定病毒——主要是HIV和丙肝,因此,寻找能对付已有和预想病毒的药剂依然是个艰巨的任务。
“要做的工作有很多。”北卡罗来纳大学(UNC)病毒学家 Nat Moorman 说。但科研界还有别的选择吗?“我们不想 2020 年再来一遍,”Moorman 说,“如果我们提前做好准备,它就不会再来一遍。”
准备行动
瑞德西韦的出现得益于参与抗病毒药物研发中心(AD3C)项目研究人员的高瞻远瞩,这个受 NIH 资助的项目于 7 年前启动,目标是在现有药物库中筛选出能抑制流感、冠状病毒、α病毒(如基孔肯雅病毒)、黄病毒(如登革病毒、寨卡病毒等)的药物。2017 年,AD3C 成员在动物模型中证明了瑞德西韦具有对抗冠状病毒的潜力[2]。与此同时,非洲两轮埃博拉暴发期间开展的临床试验也证明了瑞德西韦在人体内使用的安全性。

开罗Eva Pharma Facility的实验室技术人员正在研究瑞德西韦。来源:Amr Abdallah Dalsh/Reuters
正因如此,当新冠疫情突如其来时,瑞德西韦立刻就能派上用场。它可以迅速对新冠病毒展开人体测试。2020 年初,在一项为期三个月的大规模安慰剂对照试验中,临床医生证明瑞德西韦能加快 COVID-19 住院患者的康复速度[3]。可是,瑞德西韦的作用也就到此为止了。一些临床试验无法证实它对患者有任何好处[4]。何况这种药物价格高,生产难度大,而且必须在医院里通过静脉注射——这些因素在大流行中都不具备优势。
另一个快要获批的抗病毒药物或能解决其中一些问题。这种药物叫 molnupiravir,是一种易于合成的口服药物,经证明能缩短有症状 COVID-19 患者的感染时长。后期的临床试验已经在进行中。
这种药物最早也是由 AD3C 的科学家在疫情前研究的[5],这些科学家还选定了对 α 病毒和黄病毒有用的先导化合物。AD3C 项目负责人、阿拉巴马大学儿科传染病专家 Richard Whitley 说,所有这些候选药物的作用机制都是冒充基本的遗传单元,搞乱病毒复制自身基因组的能力。这些病毒本来要在复制过程中插入正确的 RNA 碱基,但现在,病毒聚合酶会被诱骗与这些药物的衍生物相结合。不过,人体聚合酶是不会上当的,所以只有病毒才会受到影响。(类似药物也被用来治疗乙肝、HIV 等其他多个病毒。)
这类药物名为核苷类似物(nucleoside analogue),由于病毒发现遗传错误的能力通常很差,因此这些药物往往对不同的病毒家族有效。直接与酶结合并阻断其功能的抗病毒药物——也就是绝大多数抗病毒药物——一般没有这么广的活性。原则上,研究人员可以通过靶向目的蛋白最保守的区域,设计出对多种病毒皆有效的药物,香港大学新发传染病研究员陈福和说。但他也表示,“传统上一直是‘一个病毒一个药’的方法。”
在研制 HIV 或丙肝新药时,这个理念特别奏效。“但事实证明,在快速应对流行病或大流行时,这种方法的效率很低。”陈福和说。
狡猾的目标
从很多方面来说,现有抗病毒药物的活性范围之所以很窄,还要归结到病毒本身的属性。其他类型的病原体——无论是细菌、真菌还是寄生虫——都能更好地被遏制,因为它们的细胞特性提供了一大把可供药物活性作用的靶标。比如青霉素就能抑制细胞壁的合成;或是唑类抗真菌药物可以破坏细胞膜。
而病毒的基因组很紧凑,缺少细胞解剖学结构,能供药物作用的靶标就不那么多了。再加上病毒的复制速度很快——拿新冠病毒来说,每位感染者每天能产生超过 100 万个病毒颗粒[6]——以及与生俱来的遗传突变能力,也就难怪大部分现有的抗病毒药物都对 COVID-19“束手无策”了。
病毒还具有可塑性,举例而言,就是对疱疹有活性的药物无法对抗冠状病毒。因此,美国哥伦比亚大学欧文医学中心的生物工程师、抗病毒药物研究员 Alejandro Chavez 很怀疑人们是否能找到“基本上能抑制一切的神奇抑制剂”。
他说:“我们更有希望发现的是能作用于整个病毒家族的抑制剂,前提是运气足够好。”最好的情况下,我们能得到一种泛冠状病毒抑制剂。但一个更合理的目标可能是对一类冠状病毒开发出一种有效药物,比如用一种药对付人类会感染但不致命的 α 冠状病毒属;再用另一种药对付 β 冠状病毒属——导致 SARS、MERS、COVID-19 的病毒都属于 β 冠状病毒属。
一旦鉴定出病毒谱系后,“之后的药物发现原理都是相同的”,位于比利时的强生全球公共卫生部门新发病原体主管 Marnix Van Loock 说。他解释道,研究人员要在近缘病毒间保守的、同时能被用来设计活性分子的必需酶的表面发现“可被药物靶向的区域”。
也就是说,这种药物靶向的是病毒本身。另一种方法是干预各种病毒抢来为己所用的人体通路。比如 Jeffrey Glenn 就在开发一款阻断一种调节脂肪酶的药物,许多病毒都使用这种酶来入侵细胞和复制。通过抑制这种酶,“你切断了病毒获得其依赖的宿主功能的途径。”斯坦福大学医学院胃肠病学家和分子病毒学家 Glenn 说。
另一个宿主导向(host-directed)的抗病毒策略来自 Glenn 之前的两名学生:新加坡南洋理工大学的材料科学家 Nam-Joon Cho 以及韩国成均馆大学的化学工程师 Joshua Jackman。他们开发了一种小的多肽药物,这种药物能在包膜病毒周围的脂质包裹体上凿孔[7]。这些脂质来自人体细胞的膜表面。但这种多肽药物只能穿透包裹病毒而不是细胞的脂质,这是因为膜结构大小以及膜折叠的程度都有差异(见“消灭病毒的多种途径”)。
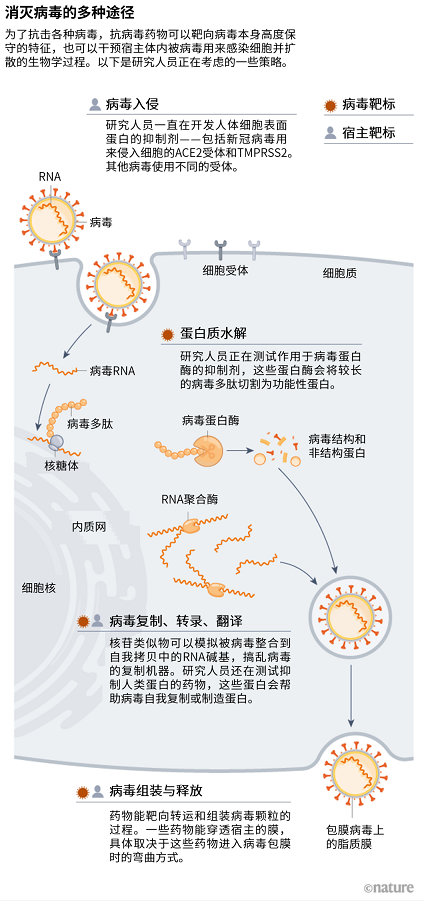
Cho 称脂质包膜是所有包膜病毒的“公分母”——这类病毒包括黄病毒、α 病毒、冠状病毒、丝状病毒、反转录病毒等等。没有其他哪种特征为这些形形色色的病毒所共有,这也是为何 Cho 认为靶向宿主的抗病毒药物在疫情防范方面或许更具潜力。
相比病毒本身,人体生物学过程提供了更多药物可作用的潜在靶标。此外,病毒不太会对靶向宿主的抗病毒药物产生抵抗力。比如,一个病毒蛋白可能只要一到两个突变就能让药物无法结合,而靶向宿主的药物或能迫使病毒使用完全不同的细胞过程。
一些研究人员担心干预人体分子通路会带来非预期的副作用,但斯坦福大学病毒学家、传染病专家 Shirit Einav 认为,这些关于毒副反应的担忧是过虑了。“我们治疗其他疾病的方式都是靶向宿主功能,”她说,而且制药公司成功找到了人群可以耐受的分子和剂量。既然如此,抗病毒药物为何会与众不同呢?她还说,“治疗急性传染只需要几天的疗程”,而不是像慢性病那样需要几个月或几年,“这也能帮助降低毒副反应”。
准备工作
将宿主靶向药物与病毒靶向(direct-acting)药物联合使用,或是应对未来病毒威胁最保险的做法。但是,无论研究人员追求的是那种策略,专家一致认为,任何为大流行准备的药物,至少要在动物模型中进行充分测试,并在健康人类志愿者中开展一定的试验。“如果哪天大流行再次暴发,我们就能快速给患者使用最佳剂量。”南非开普敦大学药物发现与研发中心主任、化学家 Kelly Chibale 说。
最终目标是在其他快速响应医学手段还没有的情况下——如疫苗或抗体疗法,在关键窗口批准这种药物并用起来。
2003 年 SARS 出现后,药物研发机构曾开展过这类工作,如辉瑞在加州的 La Jolla 实验室就设计了一种分子[8],这种分子能抑制对冠状病毒复制非常关键的一种蛋白——主要蛋白酶(Mpro),这种酶会将较长的病毒蛋白切割成功能性单元。
在六个月的时间里,“我们开展了强度很大的工作。”领导辉瑞 SARS 项目的化学家 Rob Kania 说。但那次疫情很快被扑灭了。2004 年最后几例 SARS 病例消失后,辉瑞等研发 SARS 药物的公司纷纷中止了这些项目。这些药物在当时没有市场了。UNC 的病毒学家 Timothy Sheahan 曾在制药公司工作,他指出:“你很难说服制药公司对着不存在的东西开发药物。”
Kania 团队从没有机会对其主要候选药物进行临床使用的全面优化,更不要说在小鼠或人体内进行测试了。正因为此,当新冠病毒出现后,基因组分析显示它的 Mpro 蛋白与最初的 SARS 病原体的 Mpro 几乎一模一样时,化学优化上仍有很多工作要做。当这个药物在改良后终于可以用于人体测试时[9],第一波疫情已经过去了,在全球造成了近 100 万例死亡。
这个药物名为 PF-07304814,去年 9 月作为一种静脉注射药物开始了临床试验。虽然这个研究本可以更进一步,但至少辉瑞不需要从头再来,辉瑞药物设计部主管 Charlotte Allerton 说。虽然其他制药公司也尝试阻断相同的靶点,但辉瑞是迄今唯一一家在人体测试过实验性 Mpro 抑制剂的制药公司——确切地说,辉瑞有两款抑制剂。除了这个调整了配方的 SARS 药物,上上个月,辉瑞的另一种口服候选药物 PF-07321332 也进入了临床试验。
“前期积累让我们能够快速行动,我感到高兴吗?是的,”Allerton 说,“我希望我们当初做得更多,从而能把药物更快推出市场吗?绝对的。”
敲响警钟
而那些没有开展前期工作的公司现在发誓再也不会“两手空空”了。这次的疫情是“一次警钟”,瑞士制药公司罗氏的传染病全球主管 John Young 说。“下一次疫情的出现只是时间问题,”他说,“我们作为一个产业需要准备好。”
为此,去年有 20 多家生命科学公司和风险投资公司加入了新冠研发联盟(COVID R&D Alliance),携手应对新冠病毒。该联盟现在发起了一个子项目,专门开发作用于冠状病毒和流感病毒的广谱抗病毒药物。美国安进研发策略与运营主管 Elliott Levy 是该项目的牵头人,他说联盟计划让约 25 个抗病毒候选药物进入初步的人体研究,为迎接下一次致命病毒的袭击搭建好平行检验所需的临床试验基础设施。
美国政府也有同样的目标。对付冠状病毒的抗病毒药物现在是“第一要务”,NIH 院长 Francis Collins 说。但他也告诉《自然》,如果有经费的话,相关计划肯定也会考虑其他病毒家族。”
其他研究来自耗资 7580 万欧元(约合 9010 万美元)、耗时五年的冠状病毒欧洲加速研发项目(Corona Accelerated R&D in Europe)。该项目致力于寻找当前新冠疫情和未来冠状病毒暴发的治疗药物。Moorman 和其他 UNC 的研究人员也希望通过他们的快速抗病毒药物开发计划(Rapidly Emerging Antiviral Drug Development Initiative),能从政府、产业赞助者、基金会这里筹集到 5 亿美元,用来开发靶向病毒的广谱抗病毒药物。
与此同时,一些大型药企也在加大内部投入。比如诺华就在优化一种作用于 Mpro 酶的泛冠状病毒抑制剂。诺华化学生物学与药物主管 John Tallarico 认为,公司距离人体临床测试至少还有一年的时间,而届时新冠疫情很有可能已经得到了控制。尽管如此,他说诺华还是决定推进这个项目。
但 Levy 说,“整个行业当前的投入水平与潜在的病毒风险是不成正比的”,这也是为何他希望能从制药公司这里筹集 10 亿美元,供新冠研发联盟建立防范大流行的衍生公司。他说,多余经费可能来自非营利机构和别的利益相关方。
马萨诸塞州武田制药研发总裁 Andy Plump 也是该联盟的领导者之一,他对该项目的成功很有信心。他说:“眼下,这背后集聚了很大的能量,因为新冠病毒就在我们身边。”但他不希望人们还会像上次 SARS 和 MERS 那样‘好了伤疤忘了疼’。“我们现在就要一步到位。”
参考文献:
1. Knobler, S. et al. (eds) Learning from SARS: Preparing for the Next Disease Outbreak: Workshop Summary (National Academies Press, 2004).
2. Sheahan, T. P. et al. Sci. Transl. Med. 9, eaal3653 (2017).
3. Beigel, J. H. et al. N. Engl. J. Med. 383, 1813–1826 (2020).
4. WHO Solidarity Trial Consortium N. Engl. J. Med. 384, 497–511 (2021).
5. Sheahan, T. P. et al. Sci. Transl. Med. 12, eabb5883 (2020).
6. Sender, R. et al. Preprint at medRxiv https://doi.org/10.1101/2020.11.16.20232009 (2020).
7. Jackman, J. A. et al. Nature Mater. 17, 971–977 (2018).
8. Hoffman, R. L. et al. J. Med. Chem. 63, 12725–12747 (2020).
9. Boras, B. et al. Preprint at bioRxiv https://doi.org/10.1101/2020.09.12.293498 (2021).
原文以The race for antiviral drugs to beat COVID — and the next pandemic为标题发表在2021年4月14日的《自然》的新闻特写版块上
版权声明:
本文由施普林格·自然上海办公室负责翻译。中文内容仅供参考,一切内容以英文原版为准。欢迎转发至朋友圈,如需转载,请邮件[email protected]。未经授权的翻译是侵权行为,版权方将保留追究法律责任的权利。
© 2021 Springer Nature Limited. All Rights Reserved