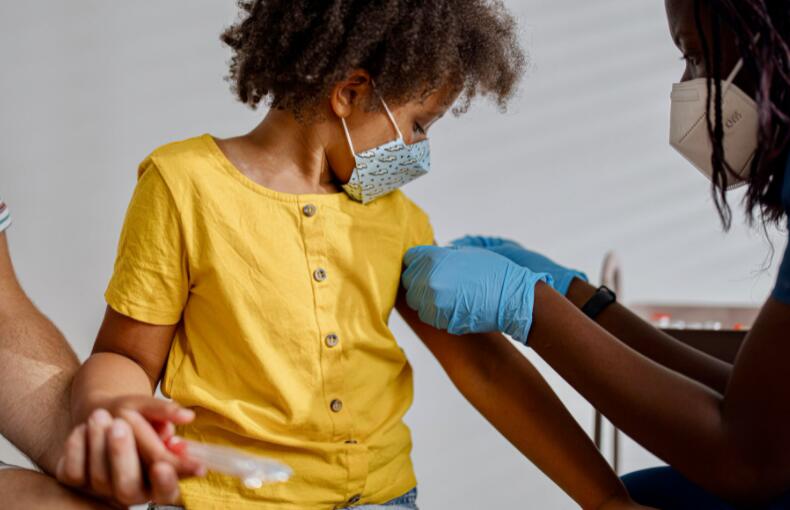
2月24日,中国国家药监局(NMPA)官网最新公示,赛诺菲(Sanofi)抗炎新药度普利尤单抗注射液(dupilumab,英文商品名Dupixent)的新适应症上市申请,已正式获得批准。根据中国国家药监局药品审评中心(CDE)优先审评公示,此次度普利尤单抗在中国获批的新适应症为:用于治疗外用药控制不佳或不建议使用外用药的6岁及以上儿童和成人中重度特应性皮炎。
度普利尤单抗是赛诺菲当前的王牌产品,根据赛诺菲近日发布的财报,2021年销售收入同比增长52.7%,销售额来到52.49亿欧元,继续奋力冲刺100亿+欧元的目标。其增长得益于成人、青少年、6-11岁儿童特应性皮炎患者的需求持续释放,以及在哮喘、慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)适应症上的标签扩大和患者渗透。
公开资料显示,度普利尤单抗是一款可同时抑制白介素-4(IL-4)和白介素-13(IL-13)的单抗,也是全球首个获得美国FDA及欧盟EMA批准治疗中重度特应性皮炎的靶向生物制剂,由赛诺菲和再生元(Regeneron)联合开发。
研究表明,IL-4和IL-13是2型炎症的关键驱动因子,而2型炎症在特应性皮炎、哮喘等疾病中起着主要作用。作为一款全人单克隆抗体,度普利尤单抗能够通过“双靶点”的创新作用机制,选择性地抑制关键信号通路IL-4和IL-13,阻断2型炎症通路,降低2型炎症的病理性反应,从机制上治疗2型炎症相关疾病。
2019年5月, 度普利尤单抗被纳入国家药品监督管理局药品审评中心(CDE)第二批临床急需境外新药名单,加速上市审批流程。2020年6月,获批用于治疗成人中重度特应性皮炎,目前已被纳入2020年国家医保目录。2021年6月,在中国递交6岁及以上至12岁以下儿童适应症获优先审评资格。2021年9月,度普利尤单抗在中国获批用于治疗外用药控制不佳或不建议使用外用药的12岁及以上青少年和成人中重度特应性皮炎。
此次儿童新适应症的获批,是基于一项关键性全球儿童三期临床试验,以及中国成人及青少年中重度特应性皮炎适应症的数据外推。这是一项随机、双盲、安慰剂对照研究,评估了度普利尤单抗与皮质类固醇联合治疗严重特应性皮炎儿童患者的安全性和有效性。试验表明,与单独使用皮质类固醇相比,联合疗法显著改善了疾病的严重程度,也缓解了瘙痒状况。
上海交通大学医学院附属新华医院皮肤科主任姚志荣教授表示:“特应性皮炎是儿童期常见病、高发病,大多数属于轻度的特应性皮炎,经过常规治疗可以获得良好的控制,但仍有部分病例对现有治疗抵抗,症状控制不佳。经多项临床研究及真实世界研究证实,度普利尤单抗可兼顾有效性和安全性,不会对生长发育产生抑制作用,对于长期控制儿童特应性皮炎患者的疾病、提升生活质量具有重要意义。”