5月17日,中国科学院物理研究所研究员姜道华、华中科技大学教授龚健科和北京大学医学部教授黄卓合作,在《自然-通讯》在线发表文章,该研究首次发现了电压门控钠离子通道NaVEh存在N型快速失活门控机制,完全不同于高等动物钠通道中经典的IFM基序介导的快失活。NaVEh的N端螺旋直接插入并阻断已激活的中央腔门孔,使其实现快速失活。为理解钠通道功能相似性,结构多样性和进化保守性提供了结构依据(见下图)。
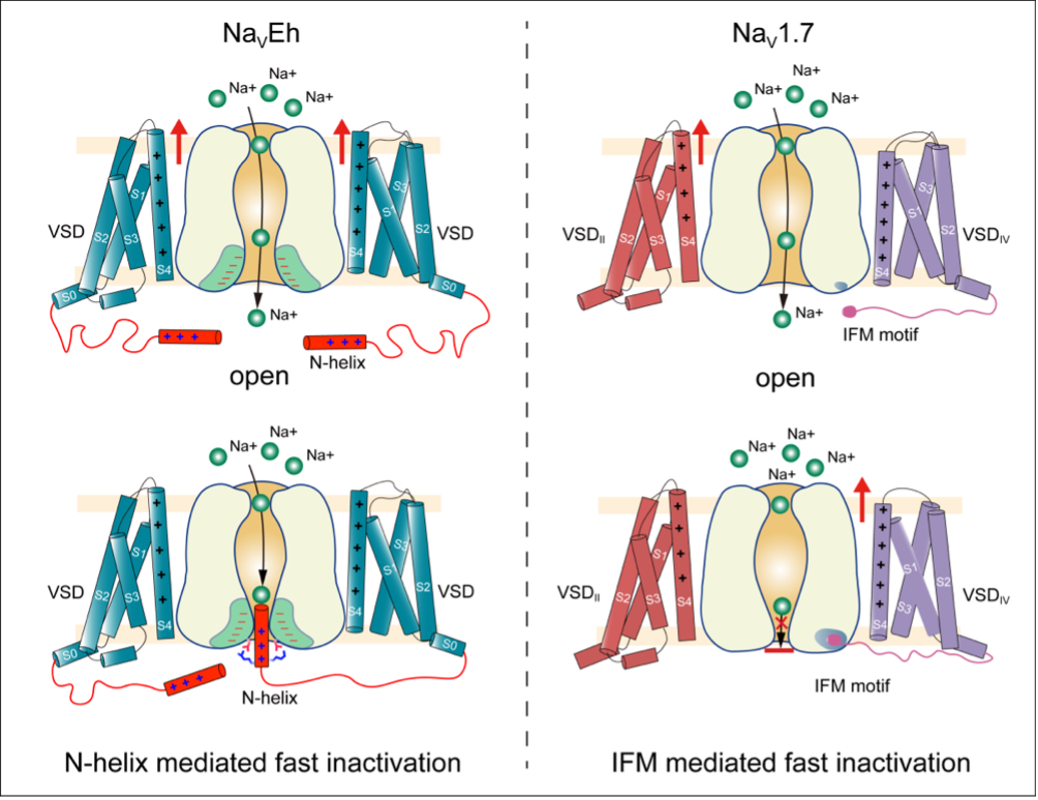 两种钠通道快速失活模式图 采访对象供图
两种钠通道快速失活模式图 采访对象供图电压门控钠通道负责启动和传播动作电位,动作电位在高等生物神经信号传递、肌肉收缩、神经递质释放等多种生理进程中发挥至关重要的作用。通道的激活和失活对于调节细胞兴奋性至关重要,任一过程的功能障碍都会导致通道功能异常并可能导致危及生命的疾病。
高等动物的钠通道通常会在几毫秒内快速失活。目前真核钠通道结构研究表明,一个保守的IFM基序作为一个疏水性闩锁,以变构方式关闭激活门。相比之下,同源四聚体原核钠通道缺乏IFM基序,也没有快失活机制,而是具有数百毫秒内的缓慢失活。从进化的角度来看,在原核钠通道的慢失活和真核钠通道的快失活之间缺失了一环。
真核单细胞生物Emiliania huxleyi是海洋植物球石藻的一种,对海洋生态至关重要,并且与气候变化高度相关。其同源四聚体钠通道(NaVEh)缺乏快失活标志性元件IFM基序,但是却有和人类钠通道相似的毫秒级别的快速失活特性。这就意味着真核生物可能存在有别于IFM基序介导的快失活机制。那么这类钠通道是如何实现快失活的呢?钠通道进化过程中有什么未被揭示的奥妙呢?
姜道华介绍,研究人员利用单颗粒冷冻电镜技术解析了真核生物球石藻钠通道NaVEh蛋白分辨率2.8 埃的结构,首次揭示了钠通道存在N型快失活门控机制,完全不同于高等动物钠通道中IFM基序介导的快失活。NaVEh的 N端螺旋插入并阻断已被激活的中央腔门孔,使其实现快速失活。
进一步的研究表明,是由于N端螺旋与中央腔门孔之间存在的多种静电相互作用导致的快失活的发生。N端螺旋缺失或者带正电氨基酸突变为负电氨基酸时会使NaVEh快速失活丧失。回补合成的N-螺旋多肽时,可以恢复NaVEh的快速失活。
此外,作者还发现,与哺乳动物钠通道显著不同的是,NaVEh从快速失活中恢复的速度比人NaV1.7慢约157倍。N-螺旋更强的结合相互作用导致从开放门释放N-螺旋的能量屏障将远高于IFM-基序从其受体位点释放的能量屏障,是导致其失活后恢复速率缓慢的主要原因。
“该研究有助于更好的理解钠通道在进化中的保守性。”姜道华告诉《中国科学报》,“NaVEh的快速失活对于单细胞浮游植物耐受生活环境中高浓度的钠可能很重要,但其缓慢的失活恢复可能阻止了这种机制在需要高频电信号的高等动物中使用;从而使高等动物在进化中选择了以快速失活和快速恢复为特点的IFM-基序介导的快速失活。”
相关论文信息:
https://doi.org/10.1038/s41467-022-30400-w